T 6541:2013
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 3
4 要求事項························································································································· 3
4.1 一般 ···························································································································· 3
4.2 使用目的 ······················································································································ 3
4.3 デザイン特性 ················································································································ 3
4.4 原材料の特性 ················································································································ 3
4.5 最終製品の特性 ············································································································· 4
4.6 従来形又は類似の医療機器との関連··················································································· 5
4.7 リスク評価 ··················································································································· 5
4.8 感染及び微生物汚染の管理 ······························································································ 5
4.9 生物学的評価 ················································································································ 5
4.10 臨床評価 ····················································································································· 5
4.11 製造工程 ····················································································································· 5
4.12 製造工程の品質管理 ······································································································ 5
4.13 包装 ··························································································································· 5
4.14 表示及び添付文書 ········································································································· 6
参考文献 ····························································································································· 7
附属書JA(参考)JISと対応国際規格との対比表 ······································································· 8
T 6541:2013
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,日本歯科材料工業協同組合(JDMA)及び一
般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定すべきとの申出があり,
日本工業標準調査会の審議を経て,厚生労働大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格
JIS
T 6541:2013
歯科用インプラントシステムの技術文書
Contents of technical file for dental implant systems
序文
この規格は,2010年に第2版として発行されたISO 10451を基とし,定義などの技術的内容を変更して
作成した日本工業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格を変更している事項である。変更の一
覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,手術後に口くう(腔)内にとど(留)まる歯科用インプラント及びその既製部品の技術文
書に対する要求事項について規定する。
この規格は,歯科用インプラントシステムのうち,口くう内にとどまらない器具及び他の部品には適用
しない。ただし,これらの構成品に関係する文書は,ここで規定する技術文書に含めてもよい。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 10451:2010,Dentistry−Contents of technical file for dental implant systems(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS T 0801-1 ヘルスケア製品の滅菌−エチレンオキサイド−第1部:医療機器の滅菌プロセスの開発,
バリデーション及び日常管理の要求事項
注記 対応国際規格:ISO 11135-1,Sterilization of health care products−Ethylene oxide−Part 1:
Requirements for development,validation and routine control of a sterilization process for medical
devices(IDT)
JIS T 0806-1 ヘルスケア製品の滅菌−放射線−第1部:医療機器の滅菌プロセスの開発,バリデーシ
ョン及び日常管理の要求事項
注記 対応国際規格:ISO 11137-1,Sterilization of health care products−Radiation−Part 1: Requirements
for development,validation and routine control of a sterilization process for medical devices(IDT)
JIS T 0806-2 ヘルスケア製品の滅菌−放射線−第2部:滅菌線量の確立
注記 対応国際規格:ISO 11137-2,Sterilization of health care products−Radiation−Part 2: Establishing
the sterilization dose(IDT)
2
T 6541:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JIS T 0806-3 ヘルスケア製品の滅菌−放射線−第3部:線量測定にかかわる指針
注記 対応国際規格:ISO 11137-3,Sterilization of health care products−Radiation−Part 3: Guidance on
dosimetric aspects(IDT)
JIS T 0816-1 ヘルスケア製品の滅菌−湿熱−第1部:医療機器の滅菌プロセスの開発,バリデーショ
ン及び日常管理の要求事項
注記 対応国際規格:ISO 17665-1,Sterilization of health care products−Moist heat−Part 1:
Requirements for the development,validation and routine control of a sterilization process for
medical devices(IDT)
JIS T 0841-1 最終段階で滅菌される医療機器の包装−第1部:材料,無菌バリアシステム及び包装シ
ステムに関する要求事項
注記 対応国際規格:ISO 11607-1,Packaging for terminally sterilized medical devices−Part 1:
Requirements for materials,sterile barrier systems and packaging systems(IDT)
JIS T 0841-2 最終段階で滅菌される医療機器の包装−第2部:成形,シール及び組立プロセスのバリ
デーション
注記 対応国際規格:ISO 11607-2,Packaging for terminally sterilized medical devices−Part 2: Validation
requirements for forming,sealing and assembly processes(IDT)
JIS T 0993-1 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及び試験
注記 対応国際規格:ISO 10993-1,Biological evaluation of medical devices−Part 1: Evaluation and
testing within a risk management process(MOD)
JIS T 0993-7 医療機器の生物学的評価−第7部:エチレンオキサイド滅菌残留物
注記 対応国際規格:ISO 10993-7,Biological evaluation of medical devices−Part 7: Ethylene oxide
sterilization residuals(IDT)
JIS T 6001 歯科用医療機器の生体適合性の評価
注記 対応国際規格:ISO 7405,Dentistry−Evaluation of biocompatibility of medical devices used in
dentistry(MOD)
JIS T 14971 医療機器−リスクマネジメントの医療機器への適用
注記 対応国際規格:ISO 14971,Medical devices−Application of risk management to medical devices
(IDT)
JIS Z 8317-1 製図−寸法及び公差の記入方法−第1部:一般原則
注記 対応国際規格:ISO 129-1,Technical drawings−Indication of dimensions and tolerances−Part 1:
General principles(MOD)
ISO 10993-9,Biological evaluation of medical devices−Part 9: Framework for identification and
quantification of potential degradation products
ISO/TS 11135-2,Sterilization of health care products−Ethylene oxide−Part 2: Guidance on the application of
ISO 11135-1
ISO 14405-2,Geometrical product specifications (GPS)−Dimensional tolerancing−Part 2: Dimensions other
than linear sizes
ISO 14801,Dentistry−Implants−Dynamic fatigue test for endosseous dental implants
ISO 14937,Sterilization of health care products−General requirements for characterization of a sterilizing
agent and the development,validation and routine control of a sterilization process for medical devices
3
T 6541:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ISO 17664,Sterilization of medical devices−Information to be provided by the manufacturer for the
processing of resterilizable medical devices
ISO/TS 22911,Dentistry−Preclinical evaluation of dental implant systems−Animal test methods
平成17年3月23日厚生労働省令第36号“医療機器の臨床試験の実施の基準に関する省令”
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
歯科用インプラント
主として歯科用補てつ(綴)物を支持及び固定するために,頭蓋顔面領域の骨内,骨上,又は骨を貫通
して,外科的に埋植するように設計した医療機器。
3.2
歯科用インプラントシステム(dental implant system)
歯科用インプラントを技工及び臨床で調整し埋植するために必要な,また,歯科用補てつ物の作製及び
装着に必要な附属器具及び専用装置を含む,歯科用インプラントの統合的な構成部品からなる医療機器。
3.3
コーティング(coating)
歯科用インプラント又は歯科用インプラントシステム部品の表面の全体又は一部を被覆する材料の層。
3.4
技術文書(technical file)
医療機器の要求事項に対する情報又はその参照先を記載した,製造販売業者が作成する文書。
4
要求事項
4.1
一般
歯科用インプラントシステムの技術文書には,少なくとも4.2〜4.14の項目を含める。
技術文書には,実施した試験のデータに加えて,科学的文献からのデータを含めてもよい。単一の試験
から複数の性質についての情報が得られる場合には,それらの性質について個別の試験を実施する必要は
ない。
4.2
使用目的
使用目的並びに医療機器に特有な適応症及び禁忌を記載する。
4.3
デザイン特性
提示するデザイン特性についての情報は,次による。
a) デザインの設定根拠 特有のデザインに対する設定根拠を記載する。
b) 寸法 寸法及び公差を記した設計図面を提示する。公差は,JIS Z 8317-1及びISO 14405-2によって示
すことが望ましい。
c) 表面仕上げ 要求される表面仕上げ,その特性及び特性を解析するために用いた試験方法を記載する。
4.4
原材料の特性
原材料の該当する特性及びその試験方法についての情報を提示する。
a) 電気化学的性質を含む化学的性質 化学的性質は,次による。
1) 化学成分(全ての添加物を含め,総和を質量分率100 %とする。)
4
T 6541:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2) 関連する不純物及びその上限
3) 溶解性及び試験方法
4) 分解性及び試験方法
5) 材料の可能な組合せ及び相互作用に関する情報
6) 吸水性及び試験方法(高分子材料の場合)
7) 耐食性及び電気化学的性質並びに試験方法(金属材料の場合)。ただし,次の場合には,その根拠及
び臨床的安全性を提示して,いずれか一方の性質で評価できる。
7.1) 異種金属との組合せが類似の医療機器として既に市販されている場合
7.2) 原材料が既に市販されている類似の医療機器に使用され,異種金属との組合せがない場合
b) 物理的性質 物理的性質は,次による。
1) X線造影性
2) 磁気的性質(強磁性又は非磁性)
3) 表面気孔率(気孔径及び気孔分布)
4) 結晶学的性質
5) 液相点及び固相点(該当する場合)
c) 機械的性質 機械的性質は,次による。
1) 金属材料
1.1) 原材料の状態(冷間加工,熱処理など)
1.2) 耐力(降伏応力)
1.3) 引張強さ
1.4) 破断伸び(%)
1.5) 弾性率
2) セラミック材料(コーティングは除く。)
2.1) 曲げ強さ及び試験方法
2.2) 破壊じん(靱)性
3) 高分子材料
3.1) 曲げ強さ
3.2) 弾性率
注記 曲げ特性(曲げ強さ,弾性率)の試験方法は,JIS K 7171に規定されている。
4.5
最終製品の特性
原材料から予測できない特性を確認するための試験については,最終製品を用いて行い,該当する場合
には,次の試験結果及び試験方法を提示する。
a) 外観 形状の異常,表面のばり,きず,異物の付着・被覆などの目視による観察結果。
b) 疲労試験 ISO 14801による疲労試験の結果。該当する場合には,上部構造に連結される推奨部品を
組み合わせて試験を実施する。
c) コーティングの密着強さ 基材に対するコーティングの密着強さ及びその試験方法(歯科用インプラ
ント又は歯科用インプラントシステムの部品がコーティングされている場合。)。
d) 生物学的性質 最終製品の生物学的評価及び試験の結果並びに試験の選択理由。生物学的評価及び試
験については,4.9による。
5
T 6541:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
e) 分解性 ISO 10993-9による分解性試験の結果。
4.6
従来形又は類似の医療機器との関連
歯科用インプラントシステムを,既に市販されている一つ以上の従来形又は類似の医療機器に基づいて
開発及び/又は評価する場合には,それらの医療機器についての情報との関連を示す。
4.7
リスク評価
JIS T 14971によるリスク分析及びリスク評価についての文書を提示する。
4.8
感染及び微生物汚染の管理
提示しなければならない情報は,次による。
a) 消毒 歯科用インプラントの設計及び製造工程において,微生物又はその他に汚染されることによっ
て生じるリスクを最小限にするためにとられた対策を提示する。これに関連して必要な消毒法を記載
する。
b) 滅菌 出荷時の状態(非滅菌又は滅菌)を示す。
製品を滅菌状態で出荷する場合には,滅菌法及びそのバリデーションを記載する。製品をエチレン
オキサイドで滅菌する場合には,JIS T 0993-7とともに,JIS T 0801-1及びISO/TS 11135-2を適用す
る。放射線による場合には,JIS T 0806-1,JIS T 0806-2及びJIS T 0806-3を適用し,他の方法による
場合には,ISO 14937を適用する。
使用者による滅菌が必要な場合には,少なくとも一つのバリデーションした滅菌法をISO 17664に
よって提示する。滅菌を湿熱で行う場合には,JIS T 0816-1を適用する。再滅菌禁止の場合には,そ
の旨を記載する。
4.9
生物学的評価
最終製品の生物学的評価を提示する。生物学的評価及び試験の指針として,JIS T 0993-1,JIS T 6001及
びISO /TS 22911を参考とする。
外科インプラント用材料について,生体適合性が規定されているJIS又はISO規格(例えば,JIS T 7401-1,
JIS T 7401-2,ISO 6474-1及びISO 13356)の,成分に関する要求事項に適合する材料に対しては,追加の
生物学的試験は必要ない。
4.10 臨床評価
臨床評価の結果を文書として提示する。
臨床試験が必要な場合には,平成17年3月23日厚生労働省令第36号によって要求される事項を文書で
保管する。
4.11 製造工程
製造工程の詳細について,特定の設計仕様が達成されていることを保証するための手段の記述を含めて
提示する。最終製品上に残留する製造用物質の分析を実施し,結果を示す。製造用物質の許容値について
の根拠を提示する。
4.12 製造工程の品質管理
工程管理及び最終製品の検査方法を含めて,品質管理の方法を詳細に提示する。
4.13 包装
4.13.1 直接の容器
容器の原材料が歯科用インプラント表面に付着する可能性を考慮して,直接の容器については,その原
材料を用いた根拠を含めて提示する。JIS T 0841-1及びJIS T 0841-2を参照する。
6
T 6541:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
滅菌状態で出荷する場合には,滅菌工程を,その製造工程並びに包装で実施したバリデーション及び対
策とともに記載する。製造販売業者が指定する保管及び輸送条件の下で,保護包装を開封するまで無菌状
態が維持されている根拠を提示する。
4.13.2 保管及び輸送中の損傷保護
保管,輸送及び取扱い中に,製造販売業者が指定する条件(必要であれば,温度,湿度及び圧力の制御
を含めて)で,包装の損傷及び劣化が生じないように,製造販売業者が実施した対策を提示する。
4.14 表示及び添付文書
4.14.1 表示
歯科用インプラントの包装には,次の事項を表示しなければならない。その表示内容を技術文書に示す。
a) 歯科用インプラント又は歯科用インプラントシステムの部品,及び包装内容
b) “滅菌済み”の旨の表示,滅菌方法及び滅菌有効期間(滅菌品の場合)。歯科用インプラントを,滅菌
及び非滅菌の両方の状態で提供する場合には,包装及び表示にいずれの状態にあるかを明瞭に記載す
る。
c) 歯科用インプラント又は歯科用インプラントシステム部品の,使用期限(必要な場合)
d) 単回使用である旨(該当する場合)
e) 保管条件及び/又は取扱い条件
f)
製造販売業者の名称及び所在地
g) 製造番号又は製造記号
h) 他の法定表示事項
上記の全ての表示事項を単一のラベルに記載することが望ましい。単一のラベルに記載できない場合に
は,外包装上に表示するか,又は添付文書に記載しなければならない。
4.14.2 添付文書
歯科用インプラントには,次の事項を記載した添付文書を添付しなければならない。その添付文書の内
容を技術文書に示す。
a) 4.14.1のb),c)及びg)を除く4.14.1に規定した事項の詳細
b) 使用目的
c) 上部構造と連結する全ての部品を正しく使用するための詳細
d) 使用時に滅菌状態を保証するための推奨する開封方法(滅菌品の場合)
e) 外科手術及び埋植の手順,並びに部品の使用方法についての詳細
f)
リスク低減についての情報(該当する場合)
g) 滅菌包装が損傷した場合に,その後にとるべき手順,及び適切な再滅菌方法の詳細(該当する場合)
h) 歯科用インプラント又は歯科用インプラントシステムの部品を使用する前に,必要となる追加の処置
及び取扱いの詳細(例えば,滅菌,最終組立て)
i)
禁忌及び既知の副作用
j)
予防措置について,医療従事者が患者に助言する詳細
k) 医療用画像システム及び/又は他の電磁的システムとの相互作用によって発生する可能性のあるハザ
ードに関する情報
l)
再滅菌してはならない場合には再滅菌禁止の旨
m) 他の法定記載事項
7
T 6541:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考文献
[1] JIS K 7171:2008 プラスチック−曲げ特性の求め方
注記 対応国際規格:ISO 178:2010,Plastics−Determination of flexural properties(MOD)
[2] JIS T 7401-1 外科インプラント用チタン材料−第1部:チタン
注記 対応国際規格:ISO 5832-2,Implants for surgery−Metallic materials−Part 2: Unalloyed titanium
(MOD)
[3] JIS T 7401-2 外科インプラント用チタン材料−第2部:チタン 6-アルミニウム 4-バナジウム合金
展伸材
注記 対応国際規格:ISO 5832-3,Implants for surgery−Metallic materials−Part 3: Wrought titanium
6-aluminium 4-vanadium alloy(MOD)
[4] ISO 1942,Dentistry−Vocabulary
[5] ISO 6474-1,Implants for surgery−Ceramic materials−Part 1: Ceramic materials based on high purity alumina
[6] ISO 13356,Implants for surgery−Ceramic materials based on yttria-stabilized tetragonal zirconia (Y-TZP)
8
T 6541:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
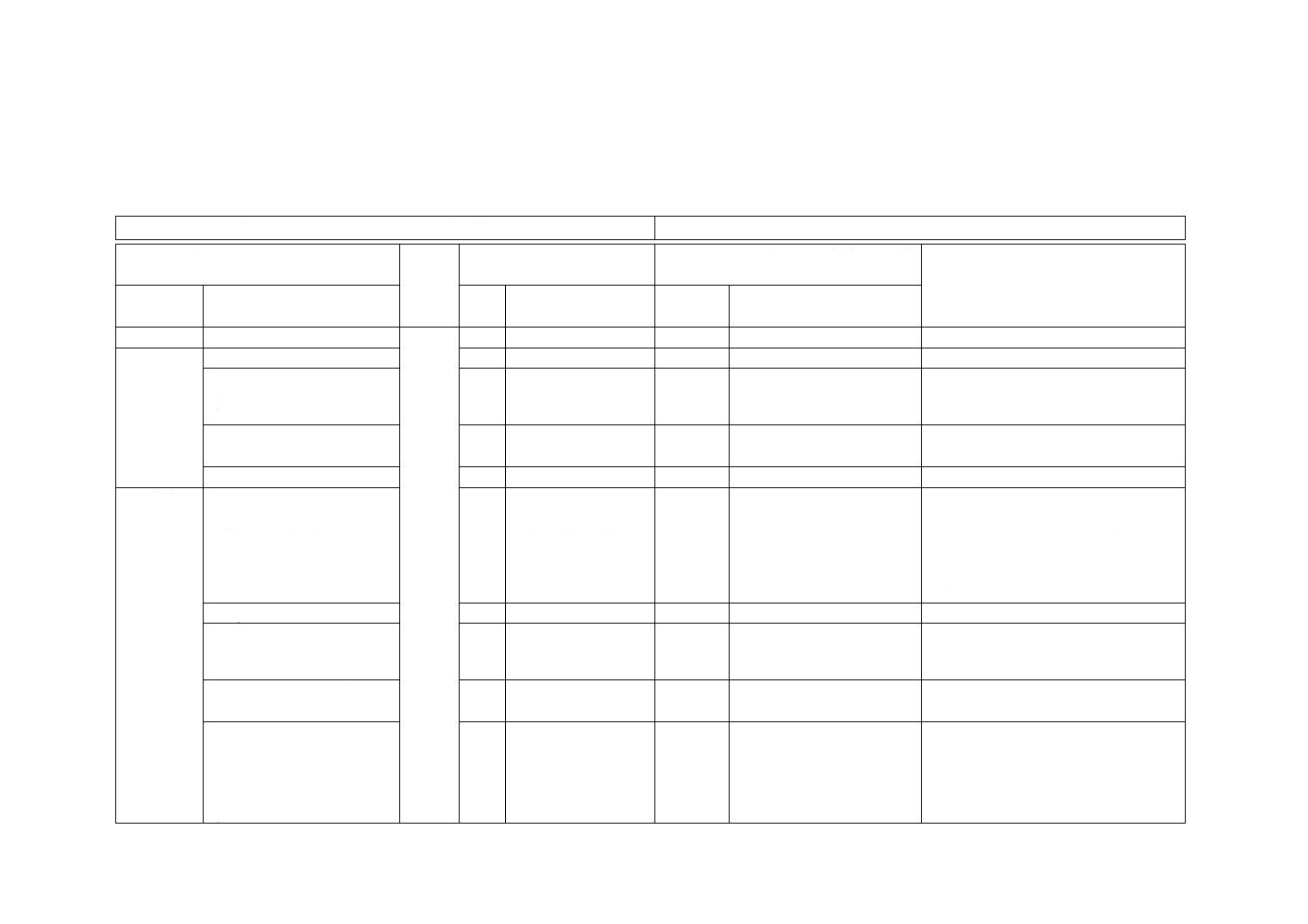
附属書JA
(参考)
JISと対応国際規格との対比表
JIS T 6541:2013 歯科用インプラントシステムの技術文書
ISO 10451:2010 Dentistry−Contents of technical file for dental implant systems
(I)JISの規定
(II)
国際規
格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇
条ごとの評価及びその内容
(V)JISと国際規格との技術的差異の理
由及び今後の対策
箇条番号及
び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
2 引用規格
3 用語及び
定義
3.1 歯科用インプラント
−
追加
定義を追加した。
ISO 1942を引用しないため。
3.2歯科用インプラントシス
テム
歯科用インプラントの
3.2
−
追加
“歯科用インプラントの”
を追加した。
歯科用インプラントを含むシステムで
あることを明確にするため。
3.4 技術文書
製造販売業者
3.3
製造業者
変更
製造販売業者に変更した。
以下同様
薬事法による。
−
3.4
吸水性
削除
用語を削除した。
公知の用語であるため。
4 要求事項 4.4 原材料の特性
a) 7) 耐食性及び電気化学的
性質並びに試験方法(金属材
料の場合)
4.4
構成材料の性質
a) 7) 腐食データ及び
電気化学的性質
追加
ただし書きを追加した。
同じ性質を評価するための異なる側面
であるので,異種金属との組合せが,類
似の医療機器として既に市販されてい
る場合などには,いずれか一方の性質で
評価できるようにした。
4.5 a) 外観
4.5
−
追加
外観を規定した。
他のJISに整合させた。
4.10 臨床評価
臨床試験が必要な場合には,
厚生労働省令第36号による。
4.10
臨床試験が必要な場
合には,ISO 14155-1,
ISO 14155-2による。
変更
準拠する規格を変更した。
我が国の法規による。
4.14 表示及び添付文書
4.14
4.15
ラベル
取扱説明書
変更
JISでは二つの項目名を合
わせた項目名とした。
他のJISに整合させた。
4.14.1 表示
h) 他の法定表示事項
4.14
h) 警告及び/又はと
るべき予防措置
i) 臨床試験用である
場合の表示
−
削除
削除
追加
ISO規格の規定を削除した。
ISO規格の規定を削除した。
JISの規定を追加した。
添付文書に記載すべき項目のため削除
した。
我が国では,技術文書の対象は,承認さ
れたインプラントなどに限るため。
法定要求事項である。
2
T
6
5
4
1
:
2
0
1
3
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9
T 6541:2013
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
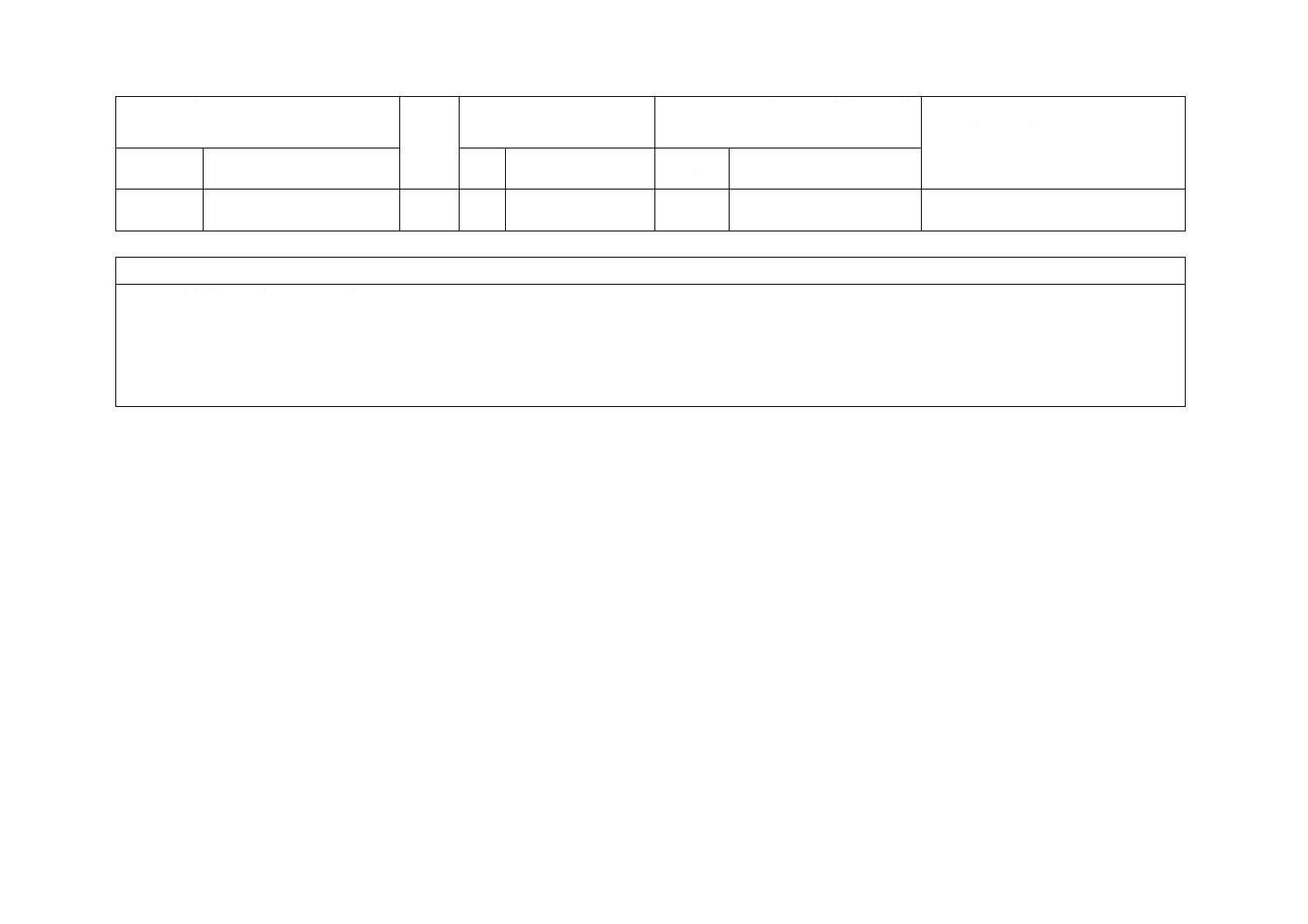
(I)JISの規定
(II)
国際規
格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇
条ごとの評価及びその内容
(V)JISと国際規格との技術的差異の理
由及び今後の対策
箇条番号及
び題名
内容
箇条
番号
内容
箇条ごと
の評価
技術的差異の内容
4 要求事項
(続き)
4.14.2 添付文書
m) 他の法定記載事項
4.15
取扱説明書
追加
JISの規定を追加した。
添付文書の記載事項である。
JISと国際規格との対応の程度の全体評価:ISO 10451:2010,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除……………… 国際規格の規定項目又は規定内容を削除している。
− 追加……………… 国際規格にない規定項目又は規定内容を追加している。
− 変更……………… 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD……………… 国際規格を修正している。
2
T
6
5
4
1
:
2
0
1
3
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。

