T 3304:2012
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 3
5 物理的要求事項 ················································································································ 4
5.1 材料 ···························································································································· 4
5.2 外観及び清浄度 ············································································································· 4
5.3 潤滑剤の量 ··················································································································· 4
5.4 針先 ···························································································································· 5
5.5 針管の寸法の許容差 ······································································································· 5
5.6 針基のテーパの合致 ······································································································· 5
5.7 引抜強さ ······················································································································ 5
5.8 漏れ ···························································································································· 6
5.9 弾性 ···························································································································· 6
5.10 曲げ強さ ····················································································································· 7
5.11 刃面マーク ·················································································································· 7
5.12 カテーテルの通過性 ······································································································ 7
5.13 せき(脊)髄くも膜下麻酔針 ·························································································· 7
6 化学的要求事項 ················································································································ 7
6.1 試験液及び空試験液の調製 ······························································································ 7
6.2 pH ······························································································································ 7
6.3 溶出金属の制限 ············································································································· 8
7 無菌性の保証 ··················································································································· 8
8 生物学的安全性 ················································································································ 8
9 エンドトキシン ················································································································ 8
9.1 硬膜外針 ······················································································································ 8
9.2 せき(脊)髄くも膜下麻酔針 ··························································································· 8
10 製造販売業者からの情報提供 ···························································································· 8
11 包装 ····························································································································· 8
11.1 一次包装 ····················································································································· 8
11.2 二次包装 ····················································································································· 8
12 表示 ····························································································································· 9
12.1 一次包装 ····················································································································· 9
12.2 二次包装 ····················································································································· 9
T 3304:2012 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
12.3 図記号の使用 ··············································································································· 9
T 3304:2012
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべ
きとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによって,JIS T 3304:2006は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3304:2012
硬膜外針
Sterile epidural needles for single use
序文
この規格は,2006年に制定されたJIS T 3304の定期見直しにおいて,使用者の利便性のため用語,文書
構成などの見直しを行い改正した日本工業規格である。
なお,対応国際規格は現時点で制定されていない。
1
適用範囲
この規格は,カテーテルの留置又は麻酔薬若しくは鎮痛薬の投与に用いる鋭利な先端をもつ滅菌済みの
器具で,そのまま直ちに使用でき,かつ,1回限りの使用で使い捨てるせき(脊)髄くも膜下・硬膜外針
(以下,硬膜外針という。)について規定する。
なお,平成27年6月30日までJIS T 3304:2006は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,記載の西暦年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS G 4305:2005 冷間圧延ステンレス鋼板及び鋼帯
JIS G 4314:1994 ばね用ステンレス鋼線
JIS T 0307:2004 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 0993-1:2012 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及
び試験
JIS T 3210:2011 滅菌済み注射筒
JIS T 3308:2012 せき(脊)髄くも膜下麻酔針
ISO 594-1:1986,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 1: General requirements
ISO 594-2:1998,Conical fittings with 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 2: Lock fittings
ISO 9626:1991,Stainless steel needle tubing for the manufacture of medical devices及びAmendment 1:2001
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
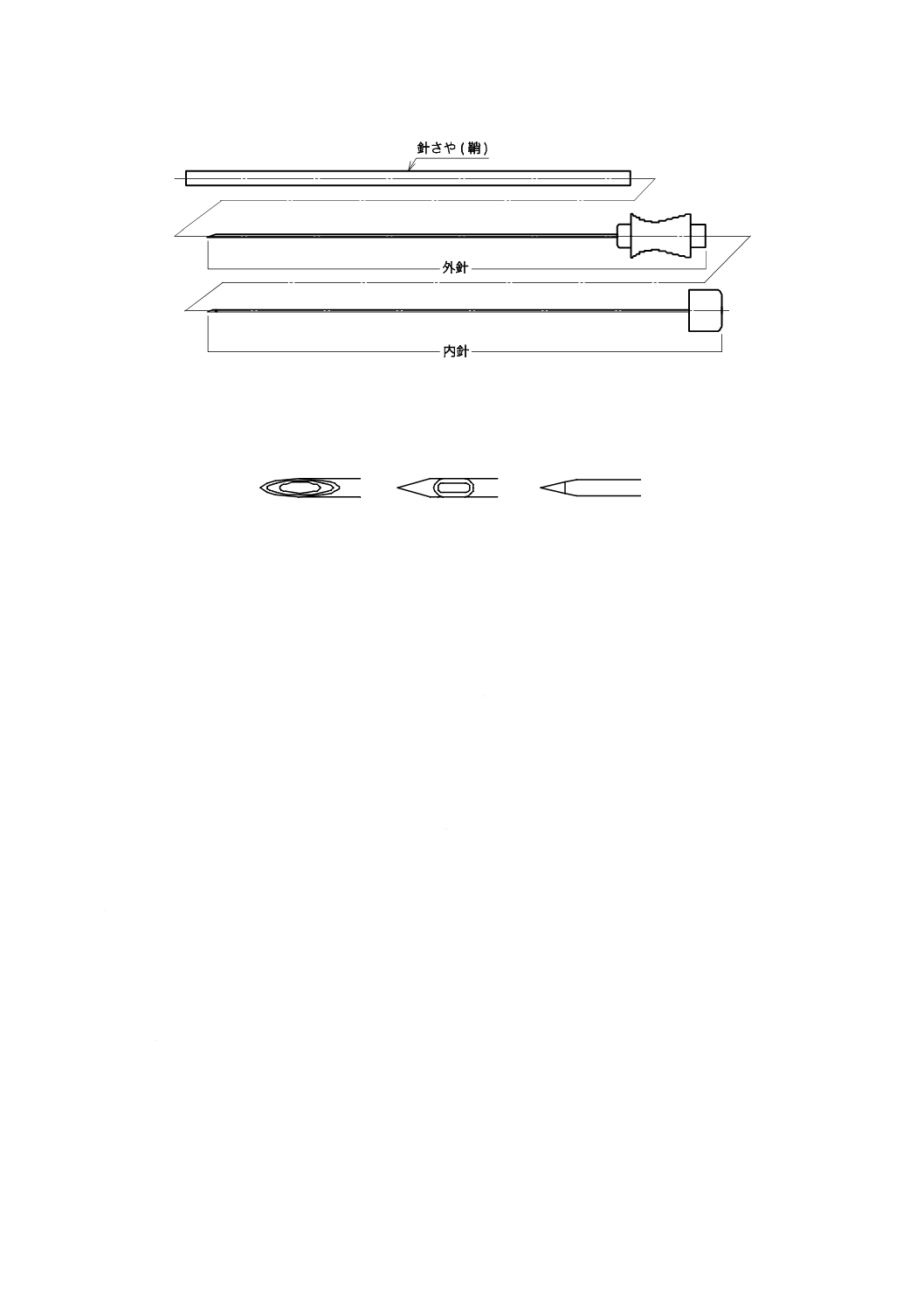
3.1
外針
2
T 3304:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
持続的に麻酔薬・鎮痛薬を投与するカテーテルの硬膜外くう(腔)への留置又は硬膜外くう(腔),くも
膜下くう(腔),若しくは仙骨管への麻酔薬・鎮痛薬を投与する目的でせん(穿)刺挿入する単くう(腔)
の針管と針基とから成る器具。針管表面に目安として目盛が付されているものもある。
3.2
スタイレット
せん(穿)刺挿入時に,針管内くう(腔)への体組織侵入を防止することを目的として,針管内くう(腔)
に挿入してあり,硬膜外くう(腔)に達したとき,外針から簡単に引き抜くことができるつまみの付いた
器具。ただし,全ての硬膜外針がスタイレットを備える必要はない。
3.3
針基
針管の針先の反対側に,注射筒などを接続するために接合されている金属製又は樹脂製の部品。
3.4
つまみ
スタイレットを引き抜くことが目的で,針先と反対側のスタイレットに取り付けてある指でつまむ部品。
3.5
翼(よく)
せん(穿)刺挿入するときに外針を押し進めるための部品。針基と一体性をもつものと取外しできるも
のとがある。
3.6
公称外径
硬膜外針の包装又は容器に表示された針管の外径の寸法。
3.7
公称長さ
硬膜外針の包装又は容器に表示された針管の長さの寸法。
3.8
精製水
日本薬局方(以下,“日局”という。)の医薬品各条に規定する“精製水”又はこれと同等以上の水。
3.9
エンドトキシン試験用水
日局の医薬品各条に規定する“注射用水”又はその他の方法によって製造した水で,エンドトキシン試
験に用いるライセート(LAL)試薬の検出限界で反応を示さないもの。
3.10
一次包装
硬膜外針を直接に覆う包装。硬膜外針の無菌性を保持するためのものをいう。さらに,これを二次包装
する場合には,“内袋”に該当する。
3.11
二次包装
一次包装を直接に覆う包装で,通常,複数の一次包装された硬膜外針。例えば,50本を入れた包装。
3
T 3304:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4
構成及び各部の名称
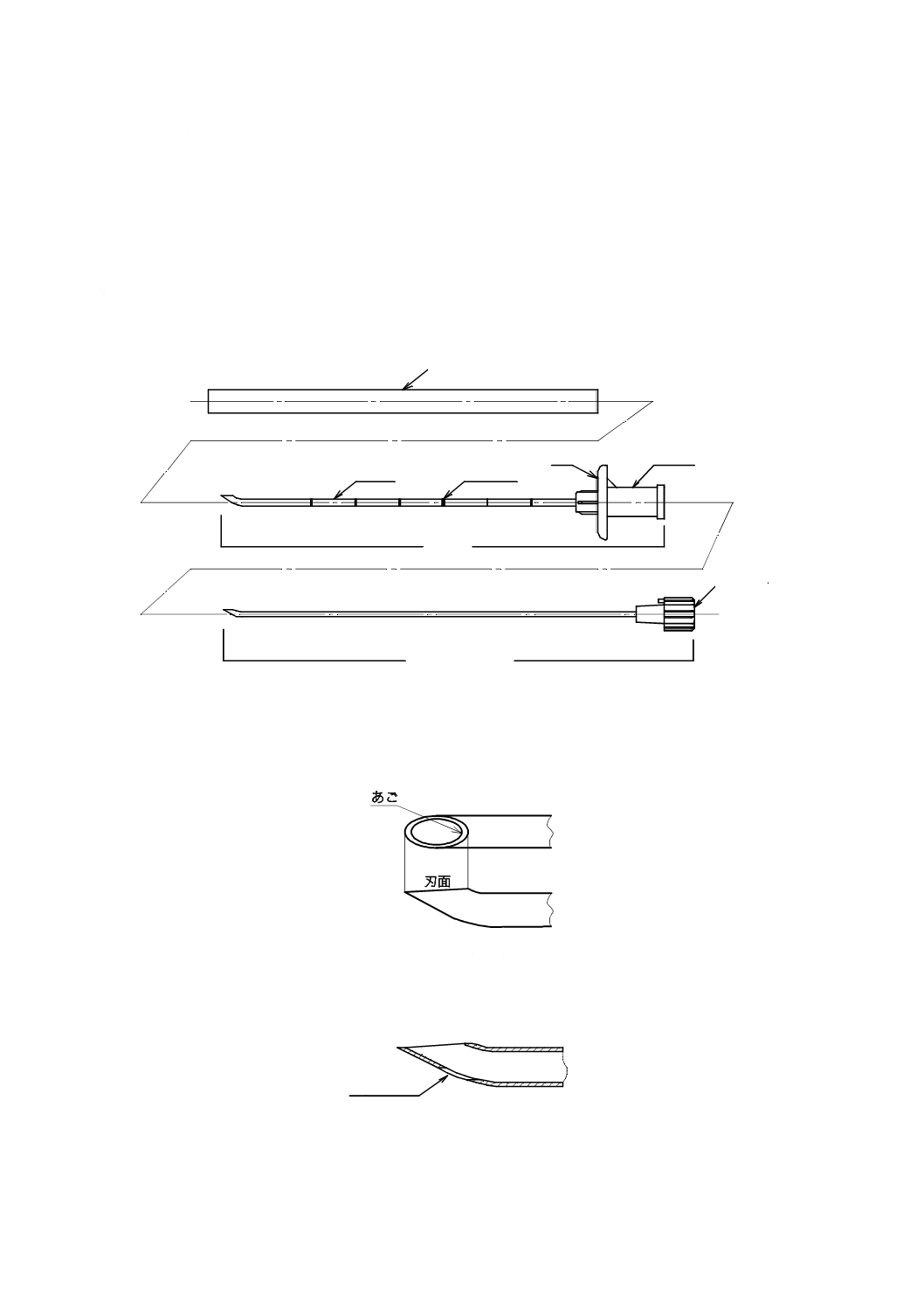
硬膜外針は,主として外針及びスタイレットで構成する(図1参照)。また,せき(脊)髄くも膜下麻酔
針を附属するもの,又はせき(脊)髄くも膜下麻酔針を組み込んでいるものがある。さらに,硬膜外針先
端にせき(脊)髄くも膜下麻酔針が出る専用孔をもつものがある(図3参照)。一般的な硬膜外針の例を
図1〜図3に,一般的なせき(脊)髄くも膜下麻酔針の例を図4及び図5に示す。また,針さや(鞘)を
附属する。針さや(鞘)は,使用前後に術者が針先を身体に誤刺しないように保護し,針基にかん(嵌)
合する。
針さや(鞘)
翼
針基
つまみ
スタイレット
外針
針管
目盛
図1−硬膜外針の各部の名称
図2−硬膜外針の針先例
専用孔
図3−専用孔がある硬膜外針の針先の断面形状例
4
T 3304:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図4−せき(脊)髄くも膜下麻酔針例
図5−せき(脊)髄くも膜下麻酔針の針先の形状例
5
物理的要求事項
5.1
材料
針管の材料は,JIS G 4305に規定するSUS304,SUS304L若しくはSUS321,又はISO 9626の材料の項
に適合するステンレス鋼とする。また,つまみを除くスタイレットの材料には,JIS G 4314に規定する
SUS304,SUS304N1若しくはSUS316,JIS G 4305に規定するSUS304,SUS304L,SUS321,又はISO 9626
の材料の項に適合するステンレス鋼と合成樹脂とを接合したものとする。ただし,合成樹脂だけのもので
もよい。
針管の潤滑剤としてシリコーン油を用いる場合,シリコーン油は,シリコーン油基準又はこれと同等以
上の基準に適合しなければならない。
注記 シリコーン油基準には,厚生労働省が定めたシリコーン油基準がある。
5.2
外観及び清浄度
外観及び清浄度は,次による。
a) 目視で検査したとき,外針及びスタイレットの外面は,凹凸及びきずがなく,仕上げ面が滑らかで,
表面に微粒子又は異物の付着があってはならない。
b) 目視で検査したとき,針管の内面には,有害な酸化物,切り粉などの微粒子又は異物の付着がなく,
ばりなどがあってはならない。また,針基の内面には微粒子又は異物の付着があってはならない。
c) 目視で検査したとき,針管に目盛又はマークが付いたものは,明確に目盛又はマークが識別できなけ
ればならない。
d) 目視で検査したとき,針管は真っすぐであり,正常な切断面及び厚さでなければならない。
5.3
潤滑剤の量
潤滑剤の量は,針管の表面に液滴を認めたり,内面にたまりを認める量であってはならない。
5
T 3304:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.4
針先
針先は,次による。
a) 針先は,鋭利に研磨してあり,目視で分かるようなばり,ささくれなどがあってはならない。また,
せき(脊)髄くも膜下麻酔針を附属するもの,又はせき(脊)髄くも膜下麻酔針を組み込むものにあ
っては,せき(脊)髄くも膜下麻酔針の先端が針先又は専用孔からスムーズに出し入れできなければ
ならない。
b) 針先は,針管とスタイレットの先端が合うなどコアリングを防止する構造とする。
注記 カテーテルを留置するものにあっては,カテーテルが針先から出るときに,カテーテルの方向
をコントロールできるように針先が形作られているものがある。
5.5
針管の寸法の許容差
針管の寸法の許容差は,次による。
a) 針管の公称外径に対する許容差は,−3〜+8 %とする。
b) 針管の公称長さに対する許容差は,10 mm以下のものは±20 %,10 mmを超え20 mm未満のものは±
8 %,20 mm以上40 mm未満のものは±7 %,40 mm以上60 mm未満のものは±5 %,及び60 mm以
上のものは±3 %とする。
5.6
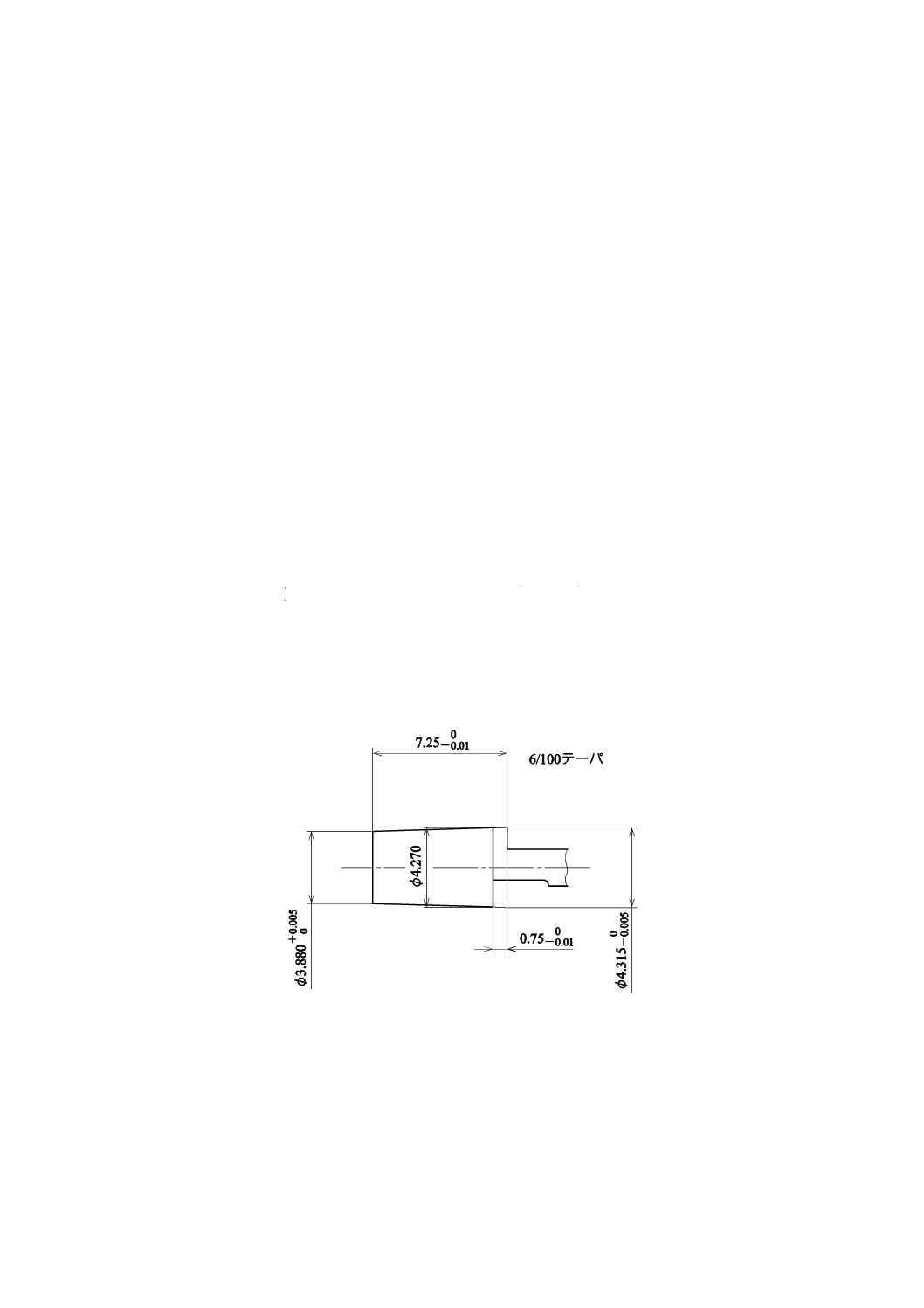
針基のテーパの合致
図6のISO 594-1に規定するおす(雄)・ルアーテーパ検査ゲージ[ISO 594-1のFigure 3−Gauges for testing
6 % (Luer) conical fittings c) Gauge for testing female conical fittings of all materials参照]を使用できる構造の
硬膜外針は,針基を5 Nの力でゲージに入れたとき,針基穴のめす(雌)・ルアーテーパとゲージのテーパ
とは合致し,かつ,針基の先端は,ゲージの限度内でなければならない。また,図6に示す検査ゲージを
使用できない構造の硬膜外針(ロック式)は,ISO 594-2に規定する検査ゲージを用いる。
単位 mm
図6−おす(雄)・ルアーテーパ検査ゲージ
5.7
引抜強さ
針管の公称外径に応じて,針管の中心軸方向に表1の力で引っ張ったとき,針管は針基から引き抜けて
はならない。
6
T 3304:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表1−引抜強さ
針管の公称外径
mm
力
N
0.3
0.33
0.36
0.4
0.45
0.5
0.55
0.6
0.65
0.7
0.8
0.9
1.1
1.2以上
22
22
22
22
22
22
34
34
34
40
44
54
69
69
5.8
漏れ
次のいずれかの方法によって試験したとき,これに適合しなければならない。
a) 第1法 スタイレットを取り外した硬膜外針の針基とJIS T 3210に適合した注射筒の筒先とを27.5 N
の力ではめ合わせる。このとき少しねじってもよい。注射筒のファーストライン(JIS T 3210参照)
を5 mLの目盛に合わせ,針の先端にゴム栓を刺し,針先から空気が漏れないようにした後,針先か
ら針基までを水中に没する。注射筒のファーストラインを2 mLの目盛まで押し,15 秒間観察する。
この間,針管と針基との接合部,及び針基と試験用注射筒の筒先とのはめ合わせ部から連続した気泡
の発生を認めてはならない。
b) 第2法 スタイレットを取り外した硬膜外針の針基を,水圧試験装置に取り付けられたISO 594-1で
規定する漏れ試験用おす(雄)円すい(錐)かん(嵌)合具(Reference steel male conical fitting)に,
27.5 Nの力ではめ合わせる。このとき少しねじってもよい。次に針管の先端にゴム栓を刺し,針先か
ら水が漏れないようにした後,0.2 MPaのゲージ圧で水を送り込み,15秒間観察する。この間,針管
と針基との接合部,及び針基と漏れ試験用おす(雄)円すい(錐)かん(嵌)合具とのはめ合わせ部
から,水滴となって落ちるような水漏れを認めてはならない。
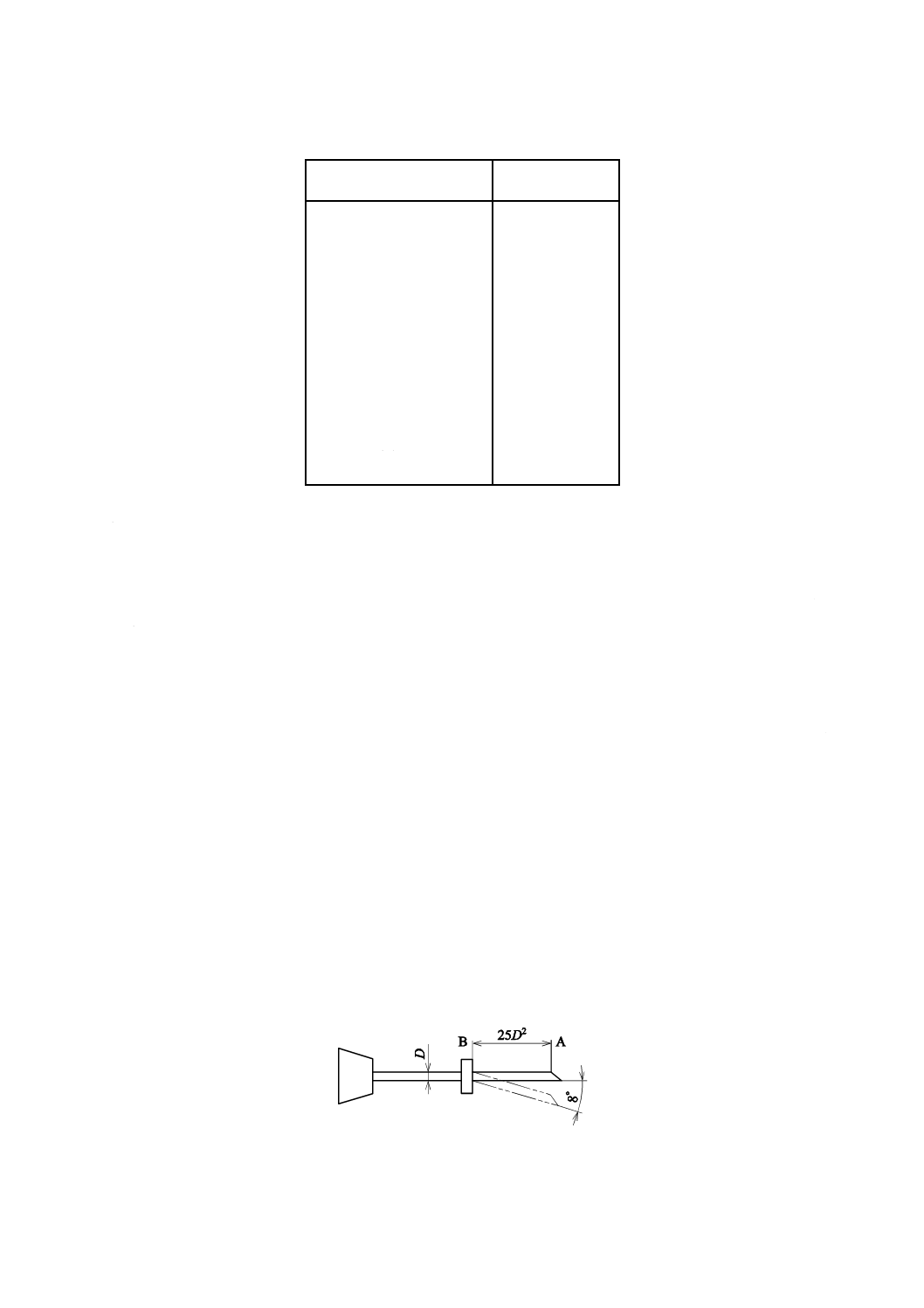
5.9
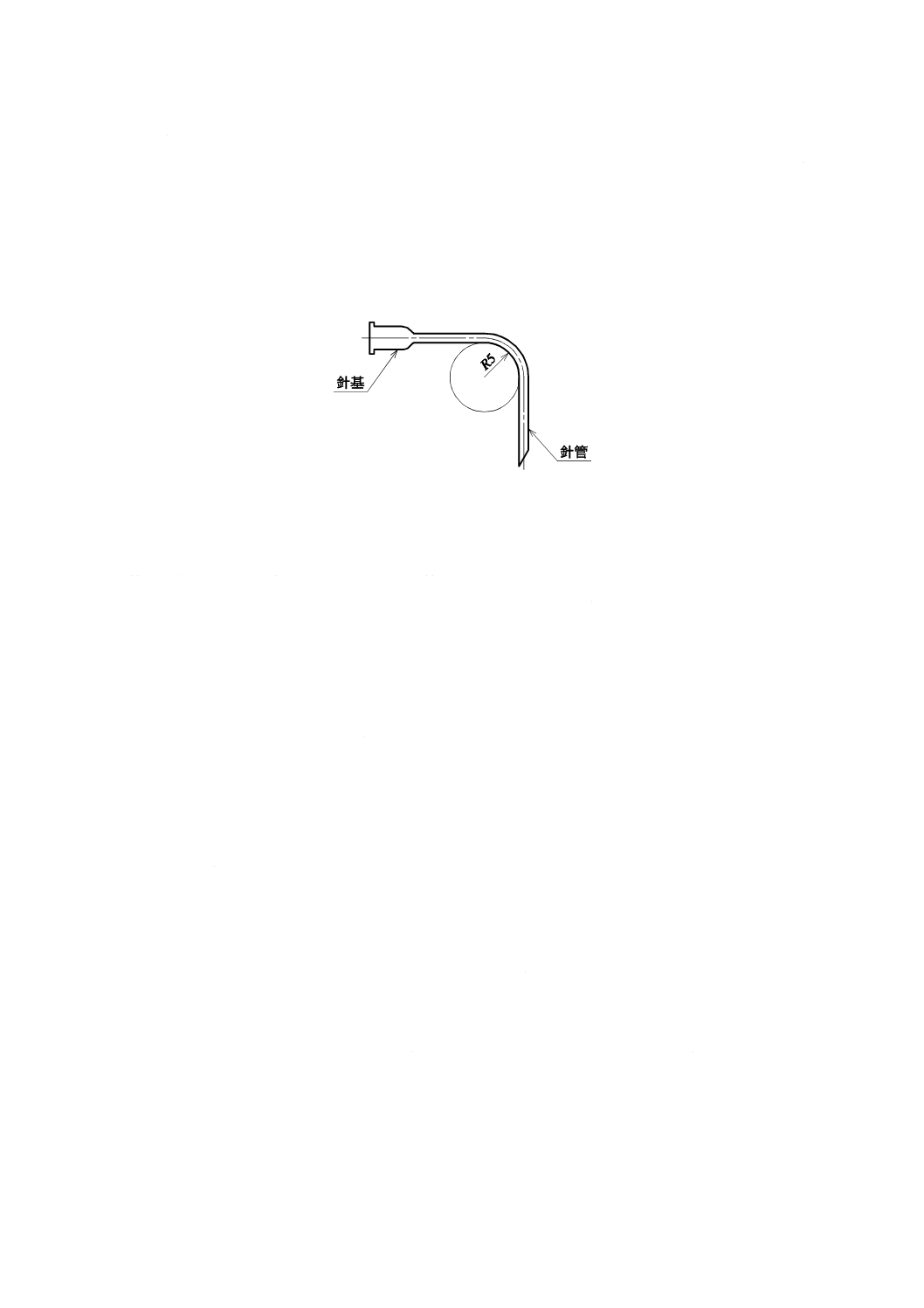
弾性
針管の公称外径(図7のD)が1.0 mm以下のものは,図7のように針管の先端の一点Aから25 D2離れ
た針管上の点Bを固定し,Aに力を加え,8度曲げて1分間保った後,放して目視したとき,針管は,元
の位置に戻らなければならない。
図7−弾性
7
T 3304:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.10 曲げ強さ
針管の公称外径が1.0 mm以下で,公称長さが12 mm以上のものは,図8のように針管を5 mmの曲率
半径で90度曲げたとき,折れてはならない。
なお,針管の公称外径が1.0 mmを超えるか,又は公称長さが12 mm未満のものには,この試験は適用
しない。
単位 mm
図8−曲げ強さ
5.11 刃面マーク
針管は,体内にせん(穿)刺した状態で,針管の刃面の向きが分かる針基,つまみ若しくは翼の形状,
構造であるか又は針基,つまみ若しくは翼に印が付けられていなければならない。
5.12 カテーテルの通過性
針管の内くう(腔)にカテーテルを通すものは,カテーテルが針管の内くう(腔)を通らなければなら
ない。
5.13 せき(脊)髄くも膜下麻酔針
せき(脊)髄くも膜下麻酔針は,JIS T 3308の5.1(材料),5.2(外観及び清浄度),5.3(針先),5.4(内
針),5.5(外針の寸法の許容差),5.6(外針針基のテーパの合致),5.7(引抜強さ),5.8(漏れ),5.9(弾
性),5.10(曲げ強さ)及び5.11(刃面マーク)に適合しなければならない。
6
化学的要求事項
6.1
試験液及び空試験液の調製
6.1.1
硬膜外針の試験液及び空試験液
硬膜外針の試験液及び空試験液は,次による。
a) 試験液 25本の硬膜外針を,スタイレットを取り除いた状態で,ほうけい酸ガラスでできた適切な容
器に入れ,250 mLの精製水に浸せき(漬)する(内側を含めた全表面を,精製水に接触するようにす
る。)。37 ℃で60±2分間加温した後,室温になるまで冷却し,硬膜外針の内外面から全ての水を
容器に戻すようにして硬膜外針を取り除き,この液を試験液とする。
b) 空試験液 同時に硬膜外針を入れない精製水を同様の方法で操作し空試験液を調製する。
6.1.2
せき(脊)髄くも膜下麻酔針の試験液及び空試験液
せき(脊)髄くも膜下麻酔針を附属又は組み込むものにあっては,JIS T 3308の6.1.1[せき(脊)髄く
も膜下麻酔針の試験液及び空試験液]によって試験液及び空試験液を調製する。
6.2
pH
+3
0
8
T 3304:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
試験液及び空試験液のpHを日局の一般試験法のpH測定法で測定したとき,両液のpHの差は1以下で
なければならない。
6.3
溶出金属の制限
原子吸光光度法又は同等以上の微量分析法によって試験液及び空試験液を分析し,試験液の測定値を空
試験液の測定値で補正したとき,試験液中の鉛,亜鉛及び鉄の合計は5 mg/L以下で,かつ,試験液のカド
ミウム測定値を空試験液のカドミウム測定値で補正したとき,試験液のカドミウムの含量は,0.1 mg/L以
下でなければならない。
7
無菌性の保証
無菌性の保証は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行う。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
8
生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行う。
9
エンドトキシン
9.1
硬膜外針
硬膜外針10本をとり,スタイレットを引き抜き,外針及びスタイレットを同じ硬質ガラス容器に入れ,
エンドトキシン試験用水30 mLを加え,融封又は適切な栓で密封してよく振り混ぜた後,室温で1時間放
置し,この液を試験液とする。この試験液調製方法では試料全体を試験用水に浸せき(漬)できない場合
は,硬膜外針10本をとり,スタイレットを引き抜き,各管内にエンドトキシン試験用水40 mLを1分間
約10 mLの速さで流し,その液で外針及びスタイレットをよく洗い,洗液を合わせて試験液とする。試験
液について,日局のエンドトキシン試験法によって試験を行ったとき,エンドトキシンの濃度は0.5 EU/mL
未満でなければならない。
9.2
せき(脊)髄くも膜下麻酔針
せき(脊)髄くも膜下麻酔針を附属又は組み込むものにあっては,せき(脊)髄くも膜下麻酔針は,JIS
T 3308の9.1[せき(脊)髄くも膜下麻酔針]に適合しなければならない。
10 製造販売業者からの情報提供
製造販売業者は,外針の内くう(腔)にカテーテルを通すものは,適切なカテーテルの情報を添付文書
などで情報提供しなければならない。
11 包装
11.1 一次包装
一次包装は,使用前に容易に破れるおそれがなく,微生物の侵入を防止することができ,通常の取扱い,
輸送及び保管中に内容製品を適切に保護できるものでなければならない。また,一度開封したら,包装は
簡単に再シールできず,開封されたことが明確に分かるものでなければならない。
11.2 二次包装
二次包装は,通常の取扱い,輸送及び保管中に内容製品を保護できる強度をもつものでなければならな
い。
9
T 3304:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
12 表示
12.1 一次包装
一次包装には,次の事項を表示する。
a) 針管の外径(mm)及び長さ(mm)
b) “滅菌済み”の旨
c) 製造番号又は製造記号
12.2 二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装を最小販売単位の包装
として用いる場合には,次の事項を一次包装に表示する。
なお,製造番号又は製造記号が滅菌年月を表している場合は,改めて滅菌年月の表示をする必要はない。
また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 承認番号
c) 販売名
d) 針管の外径(mm)及び長さ(mm)
e) 数量(入り数)
f)
“滅菌済み”の旨
g) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
h) 製造番号又は製造記号
i)
滅菌年月
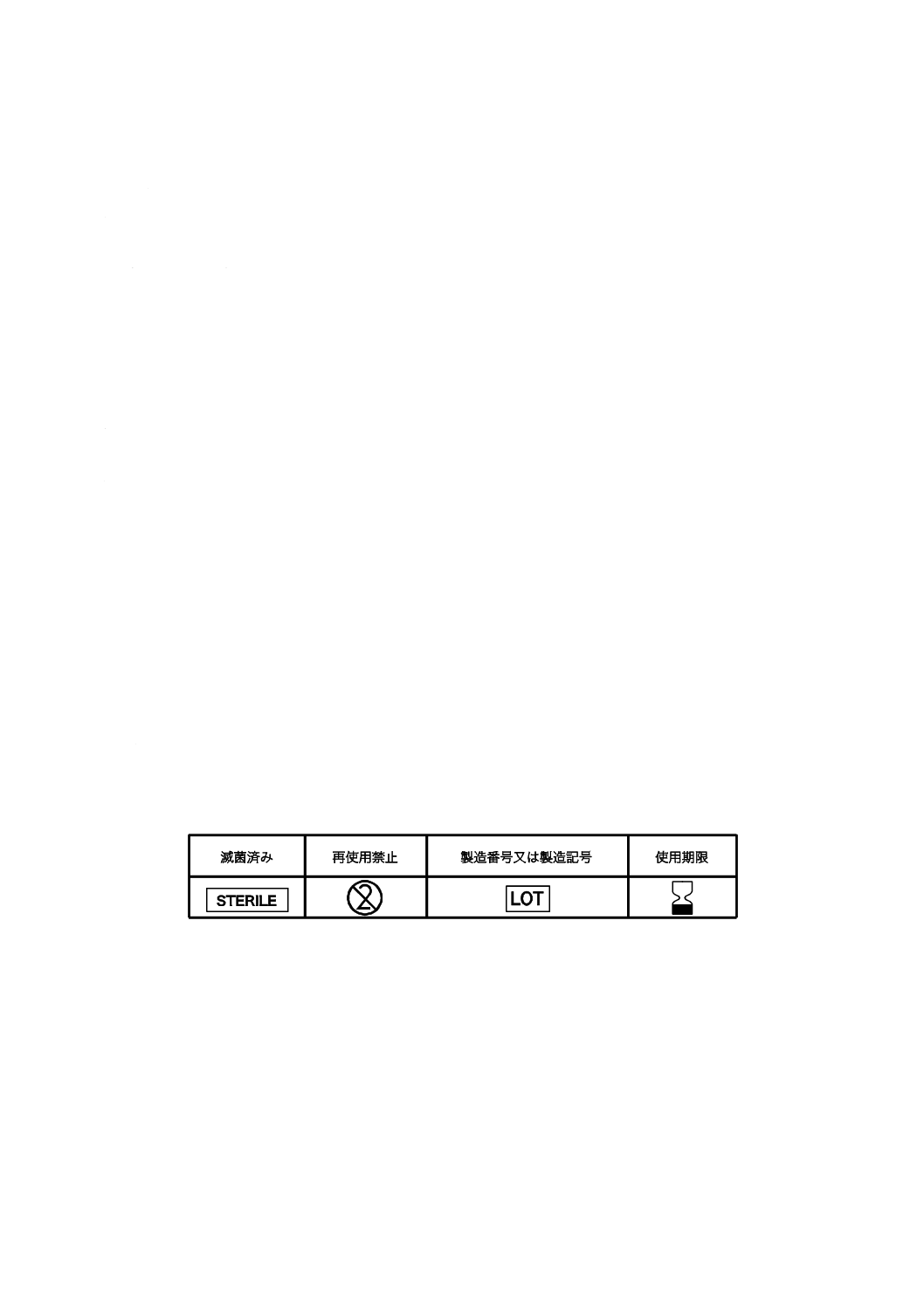
12.3 図記号の使用
12.1及び12.2の要件は,JIS T 0307に規定する適切な図記号を使用することによってこれに替えてもよ
い。
注記 JIS T 0307に規定する主な図記号の例を,表2に示す。
表2−JIS T 0307に規定する図記号の例





