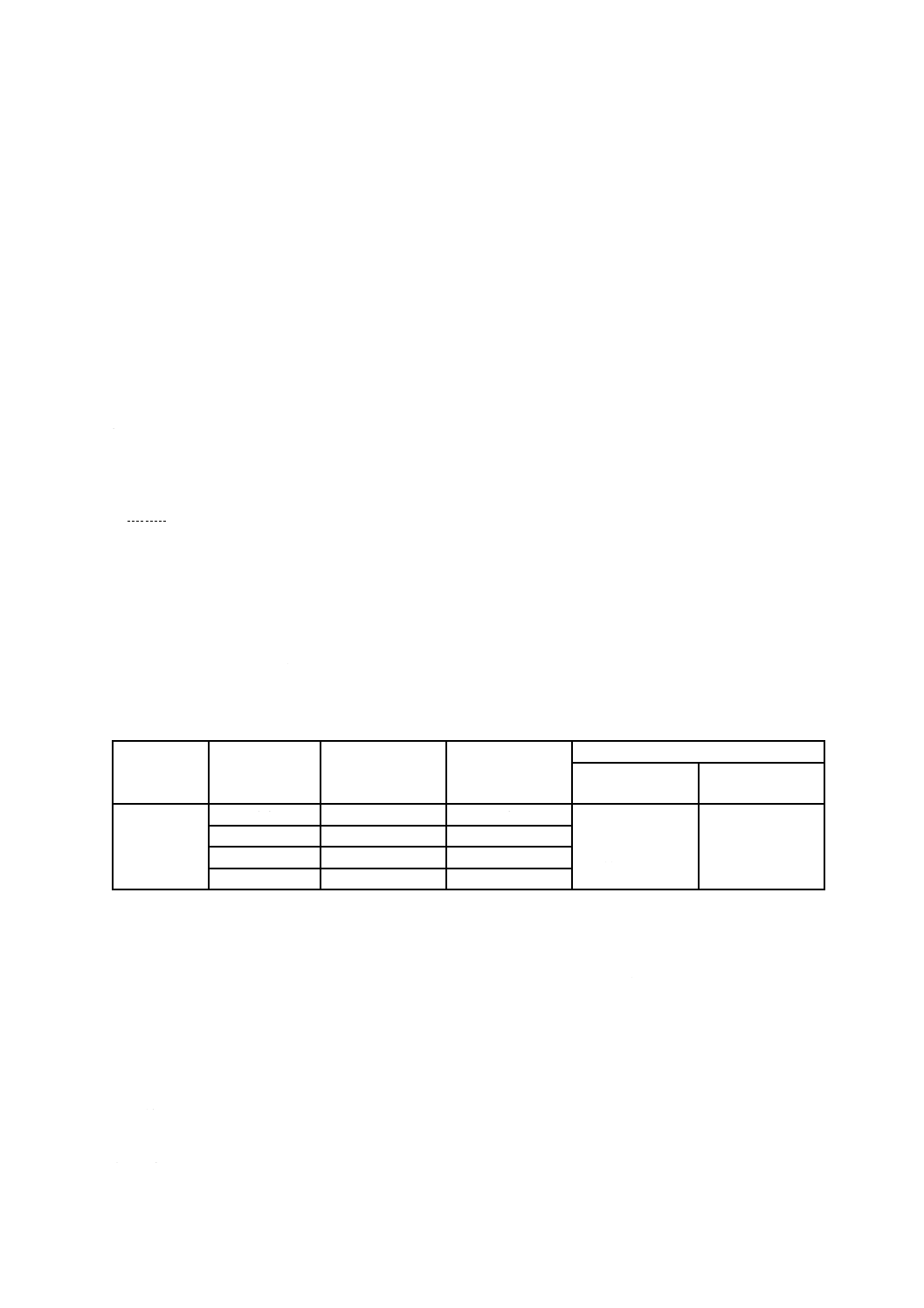T 3253:2012
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 3
5 物理的要求事項 ················································································································ 4
6 化学的要求事項 ················································································································ 5
6.1 pH ······························································································································ 5
6.2 溶出金属の制限 ············································································································· 5
7 注射筒及び針の潤滑剤 ······································································································· 5
7.1 材料 ···························································································································· 5
7.2 潤滑剤の量 ··················································································································· 5
8 公称容量の許容差 ············································································································· 5
9 目盛······························································································································· 5
9.1 目盛 ···························································································································· 5
9.2 目盛数字 ······················································································································ 6
9.3 寸法の範囲 ··················································································································· 6
10 外筒 ····························································································································· 6
10.1 構造 ··························································································································· 6
10.2 フランジ(フィンガーグリップ) ···················································································· 6
11 ガスケット・押子の組立 ·································································································· 6
11.1 構造 ··························································································································· 6
11.2 ファーストライン ········································································································· 6
11.3 外筒とガスケットとの密着 ····························································································· 6
12 筒先 ····························································································································· 7
12.1 テーパの合致 ··············································································································· 7
12.2 筒先の位置 ·················································································································· 7
13 針管及び注射針 ·············································································································· 7
13.1 注射筒形式3及び4の注射針 ·························································································· 7
13.2 注射筒形式5,6,7及び8の針管 ···················································································· 7
14 注射筒組立品の性能 ········································································································ 7
14.1 デッドスペース ············································································································ 7
14.2 針の漏れ ····················································································································· 7
14.3 ガスケットを通した液及び空気の漏れ ·············································································· 7
15 無菌性の保証 ················································································································· 8
T 3253:2012 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
16 生物学的安全性 ·············································································································· 8
17 エンドトキシン ·············································································································· 8
18 包装 ····························································································································· 8
18.1 一次包装及びセルフコンテインドシリンジユニット ···························································· 8
18.2 多数本入り包装(注射筒形式2,4,6及び8) ··································································· 8
18.3 二次包装 ····················································································································· 9
19 表示 ····························································································································· 9
19.1 一般 ··························································································································· 9
19.2 注射筒 ························································································································ 9
19.3 一次包装(注射筒形式1,3,5及び7) ············································································ 9
19.4 多数本入り包装(注射筒形式2,4,6及び8) ··································································· 9
19.5 二次包装 ···················································································································· 10
19.6 図記号の使用 ·············································································································· 10
附属書A(規定)pH及び抽出物の試験液 ················································································· 11
附属書B(規定)押子を操作したときに要求する力の試験方法 ····················································· 12
附属書C(規定)デッドスぺースの測定方法 ············································································ 13
附属書D(規定)圧力下における注射筒のガスケットと外筒との接触部及び注射筒の筒先と針基又は
針と外筒との接合部の液漏れの試験方法 ···································································· 14
附属書E(規定)減圧下における筒先と針基又は針と外筒との接合部及びガスケットと外筒との
接触部の空気漏れの試験方法 ··················································································· 16
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 17
T 3253:2012
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべ
きとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによって,JIS T 3253:2006は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3253:2012
インスリン皮下投与用注射筒
Sterile single-use syringes, with or without needle, for insulin
序文
この規格は,2007年に第2版として発行されたISO 8537を基とし,我が国の実情に合わせるため技術
的内容を変更して作成した日本工業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格を変更している事項である。変更の一
覧表にその説明を付けて,附属書JAに示す。また,附属書JAは対応国際規格にはない事項である。
1
適用範囲
この規格は,主に人に使用し,かつ,インスリンを注入する針付き又は針なしの単回使用滅菌済み注射
筒について規定する。
この規格で規定する滅菌済み注射筒は,充塡したときすぐに使用するもので,インスリンを長時間入れ
ておくものではない。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 8537:2007,Sterile single-use syringes, with or without needle, for insulin(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
なお,平成27年6月30日までJIS T 3253:2006は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,記載の西暦年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS T 0307:2004 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
JIS T 0993-1:2012 医療機器の生物学的評価−第1部:リスクマネジメントプロセスにおける評価及
び試験
JIS T 3209:2011 滅菌済み注射針
注記 対応国際規格:ISO 7864:1993,Sterile hypodermic needles for single use(MOD)
JIS T 3210:2011 滅菌済み注射筒
ISO 594-1:1986,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 1:General requirements
ISO 9626:1991,Stainless steel needle tubing for the manufacture of medical devices及びAmendment 1:2001
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
2
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.1
目盛容量(graduated capacity)
20 ℃±3 ℃又は27 ℃±3 ℃でガスケット上のファーストラインを1間隔又は数間隔の目盛を動かした
とき,排出される水の量。
3.2
公称容量
注射筒の包装又は容器に表示された注射筒の容量。
3.3
ファーストライン
外筒の目盛に合わせるガスケットの最初のピークのライン。
3.4
デッドスペース
押子が完全に挿入されている状態で,外筒及び筒先に残留する液体の量。針管が接合されているもの
は,針管に残留する液体の量を含む。注射針が取り付けられて供給されるものは,注射針内に残留する液
体の量を含む。
3.5
針キャップ(needle cap)
針管及び針基の物理的保護を意図した保護用先端キャップ。セルフコンテインドシリンジユニットの場
合は,保護用先端キャップとして針管の無菌性の維持をする機能が付加される。
3.6
針さや(鞘)(needle sheath)
針管の物理的保護を意図したカバー[図1 b)参照]。
3.7
保護用先端キャップ(protective end cap)
筒先及び/又は針を覆うことを意図したカバー。セルフコンテインドシリンジユニットの場合は,無菌
性を維持するための機能が付加される。
3.8
保護用キャップ
押子の突出した部分及びプッシュボタンを覆うことを意図したカバー。セルフコンテインドシリンジユ
ニットの場合は,無菌性を維持するための機能が付加される。
3.9
プッシュボタン
ガスケットと反対側にある押子を押し込む又は引くために着けられた部分[図1 a)参照]。
3.10
精製水
日本薬局方(以下,“日局”という。)の医薬品各条に規定する“精製水”,又はこれと同等以上の水。
3.11
エンドトキシン試験用水
日局の医薬品各条に規定する“注射用水”又はその他の方法によって製造した水で,エンドトキシン試
験に用いるライセート(LAL)試薬の検出限界で反応を示さないもの。
3
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.12
一次包装
インスリン注射筒を直接に覆う包装で,インスリン注射筒の無菌性を保持するためのもの。さらに,こ
れを二次包装する場合には,“内袋”に該当する。
3.13
セルフコンテインドシリンジユニット
保護用先端キャップ及び保護キャップで,注射筒内面,針基内面及び針管の無菌性の維持を意図したイ
ンスリン注射筒単位。
3.14
多数本入り包装
セルフコンテインドシリンジユニットを多数本,ただし,12本以下を覆う包装で,通常,無菌維持を意
図しないもの。さらに,これが二次包装される場合には,“内袋”に該当する。
3.15
二次包装
一次包装を直接に覆う包装で,通常,複数の一次包装されたインスリン皮下投与用注射筒,例えば,100
本を入れた包装。
4
構成及び各部の名称
注射筒は,外筒,ガスケット及び押子で構成し,注射筒の筒先部分に注射針をあらかじめはめ合わせた
もの,又は筒先の替わりに直接針管を接合したものがある。針管は,円筒形及び非円筒形のもの,誤刺防
止用の安全機構をもつものもある。
インスリン皮下投与用注射筒の形式は,それらの包装と針との組合せの関係で,次のようなものがある。
形式1: 注射筒は,6 %(ルアー)おす(雄)の筒先をもち,注射針なしで供給され,かつ,一次包装
に包装されているもの。
形式2: 注射筒は,6 %(ルアー)おす(雄)の筒先をもち,注射針なしで供給され,かつ,保護用先
端キャップ及び保護用キャップを取り付けているもの。
形式3: 注射筒は,6 %(ルアー)おす(雄)の筒先をもち,分離された注射針又は取外し可能な注射
針を付けて供給され,かつ,一次包装に包装されているもの。
形式4: 注射筒は,6 %(ルアー)おす(雄)の筒先をもち,取外し可能な注射針を付けて供給され,
かつ,保護用先端キャップ及び保護用キャップを取り付けているもの。
形式5: 注射筒は,6 %(ルアー)以外の筒先をもち,取外しを意図しない注射針を付けて供給され,
かつ,一次包装に包装されているもの。
形式6: 注射筒は,6 %(ルアー)以外の筒先をもち,取外しを意図しない注射針を付けて供給され,
かつ,保護用先端キャップ及び保護用キャップを取り付けているもの。
形式7: 針管を注射筒へ接合,かつ,個包装に包装されているもの。針管は,針さや(鞘)で物理的
保護がされている。
形式8: 針管を注射筒へ接合,かつ,保護用先端キャップ及び保護用キャップを取り付けているもの。
インスリン皮下投与用注射筒の一部の構成部品の名称を,図1に示す。この図は,一般的な例示である。
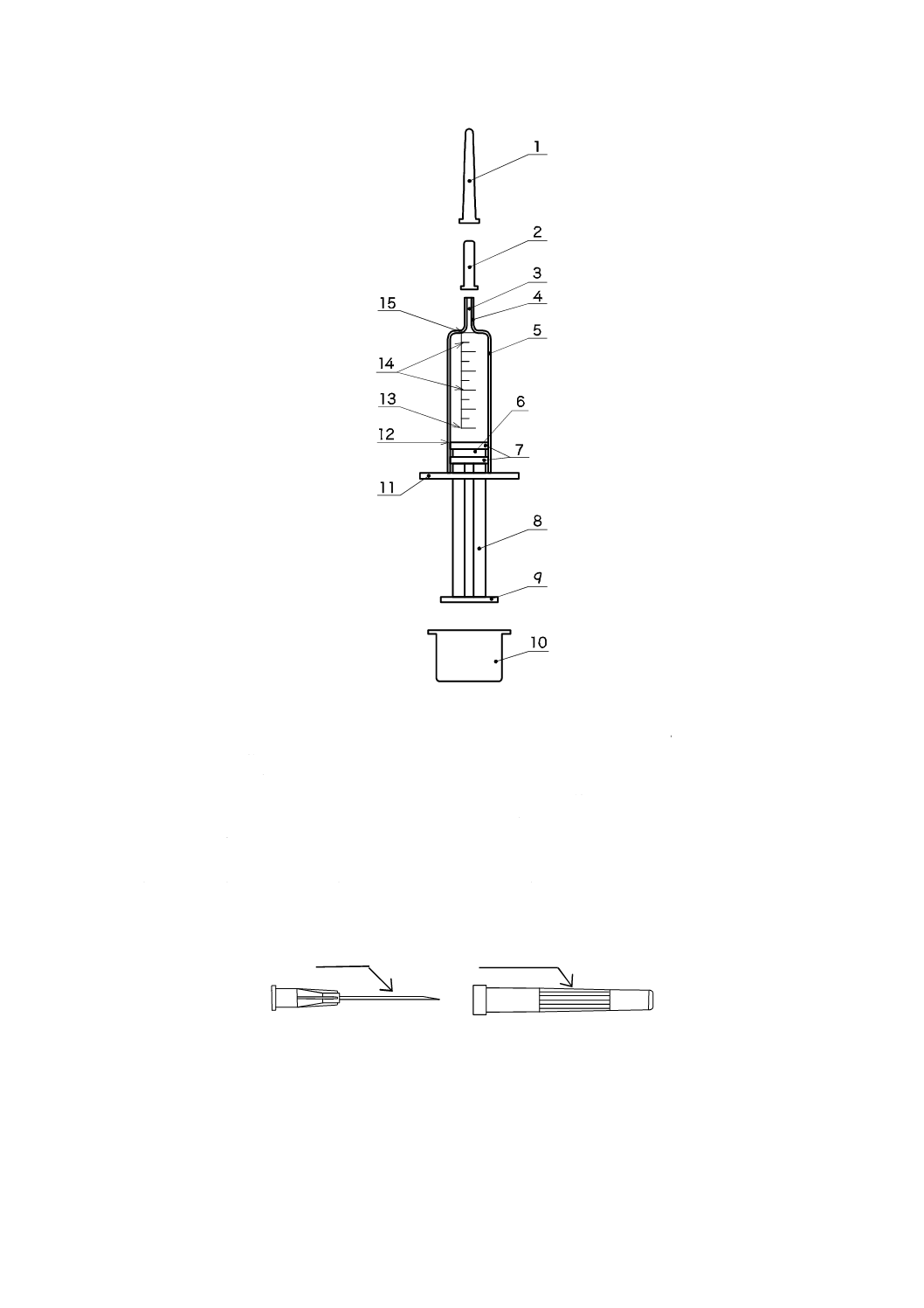
4
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
2
3
4
5
6
7
8
針キャップ
保護用先端キャップ
筒先内くう(腔)
筒先
外筒
ガスケット
シール
押子
9
10
11
12
13
14
15
プッシュボタン
保護用キャップ
フィンガーグリップ
ファーストライン
公称容量
目盛線
ゼロ線
注記 この図は,取外し可能な針又は接合した針管を示していない。そして,ガスケット/押子組立品は,完全な構
成品である場合とそうでない場合とがあり,かつ,シールは1個以上が組み入れられる。
a) 注射筒
b) 注射針
図1−単回使用インスリン注射筒の概略図及び各部の名称例
5
物理的要求事項
インスリンと接する針及び注射筒の表面は,清浄で,かつ,拡大なしに,正常又は矯正した視力で見た
とき異物があってはならない。
注射針
針さや(鞘)
5
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
6
化学的要求事項
6.1
pH
附属書Aによって準備した試験液及び空試験液のpHを,日局の一般試験法のpH測定法で測定したと
き,両液のpHの差は1以内でなければならない。
6.2
溶出金属の制限
附属書Aによって準備した試験液及び空試験液を原子吸光光度法又は同等以上の微量分析法によって分
析し,試験液の測定値を空試験液の測定値で補正したとき,試験液中の鉛,すず,亜鉛及び鉄の合計は
5 mg/L以下で,かつ,試験液のカドミウム測定値を空試験液のカドミウム測定値で補正したとき,試験液
のカドミウム含量は0.1 mg/L以下でなければならない。
7
注射筒及び針の潤滑剤
7.1
材料
内表面,ガスケット及び針管の外表面を滑らかにする潤滑剤としてシリコーン油を用いる場合,シリコ
ーン油は,シリコーン油基準又はこれと同等以上の基準に適合しなければならない。
注記 シリコーン油基準には,厚生労働省が定めたシリコーン油基準がある。
7.2
潤滑剤の量
内表面,ガスケット及び針管の外表面を滑らかにする場合,潤滑剤は注射筒の内表面にたまってはなら
ず,針管の外表面及び内くう(腔)に液滴を作ってはならない。
8
公称容量の許容差
インスリン皮下投与用注射筒の目盛容量の許容差は,表1の範囲とする。
表1−インスリン注射筒,寸法の範囲,目盛線及び容量目盛の許容差
単位
公称容量
mL
目盛の最小長さ
mm
目盛間隔
units
目盛容量の許容差
公称容量の半分
未満
公称容量の半分
又は半分以上
U-100
0.3
41
1
±(公称容量の
1.5 %+排出
量の2 %)
排出量の±5 %
0.5
43
1
1.0
57
1
1.0
57
2
9
目盛
9.1
目盛
目盛は,インスリンの単位が目盛られ,かつ,インスリンの力価だけを対象とする。公称容量は,ミリ
リットル(mL)で表示する。
目盛容量は液体を排出した質量で的確に測定ができる(3.1を参照)。
目盛線は,0.2 mm〜0.4 mmの均一の太さとする。線は,外筒の軸方向に対し直角に引かれていなければ
ならない。
目盛線は,ゼロ目盛と全容量目盛との間に,軸に沿って均一の間隔でなければならない。
注射筒を垂直に保持したとき,類似した長さの全ての目盛線の端は,お互いの垂直な直下にあり,かつ,
端部のずれは±0.5 mm以内に入っていなければならない。
6
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
短い目盛線は,長い線のほぼ半分とする。
目盛及び目盛容量数字は読みやすく,かつ,注射筒に対し明瞭な色とする。
9.2
目盛数字
目盛線は,0.3 mL及び0.5 mLの注射筒においては5単位の間隔で,1.0 mL及び2.0 mLの注射筒におい
ては10単位の間隔で数字を付ける。
数字の最低高さは3 mm以上とする。
注射筒を,目盛を前にして,ゼロ目盛を上に垂直に保持したとき,数字は目盛上に真っすぐとし,対応
する目盛線の延長部分によって2等分される位置とする。数字は,関係する目盛線の端と接触しないで接
近していることとする。
9.3
寸法の範囲
注射筒の目盛の範囲は表1による。
10 外筒
10.1 構造
外筒の長さは,公称容量より最低10 %以上の容量が使用可能であるか,又は目盛点を超えて押子が5 mm
動くかのいずれかとする。
10.2 フランジ(フィンガーグリップ)
外筒の開放側端には,水平に対し10°の角度をつけた平らな面の上に目盛を上にして置いたとき,注射
筒が回転しないことが保証できるフランジを付ける。フランジは,突起及び鋭いエッジがあってはならな
い。フランジは,適切な大きさ,形状及び用途が意図する強度があり,使用中を通じて注射筒を安全に保
持できるものとする。
11 ガスケット・押子の組立
11.1 構造
注射筒の押子及びプッシュボタンは,片手で外筒をつかんだとき,押子はその手の親指で押し下げるこ
とができる構造とする。ガスケットは,附属書Eによって試験をしたとき押子から外れてはならない。
押子の突出部及びプッシュボタンの形状は,最大挿入位置まで押し込んだとき,容易につかみ引き戻す
ことができなければならない。
11.2 ファーストライン
ガスケットのファーストラインは,注射筒の目盛の表示に一致し,目視によって目盛容量の位置を決め
るために,明瞭な線とする。
ファーストラインは,外筒の内面と接触していることとする。
3部品の注射筒に対して,ファーストラインを作るガスケットは,黒い色の材料を使用することが望ま
しい。
11.3 外筒とガスケットとの密着
注射筒を水で満たし,まず,一方を上にし垂直に保持する。その後,他方を真上に垂直に保持したとき,
押子は,自身の質量及び入っている水の質量によって動いてはならない。製造販売業者の指示に従い,注
射筒に注射針を確実に付けたとき,注射筒から水を排出するために押子を最初に動かすのに必要とする力
は,附属書Bによって測定したとき,15 Nを超えてはならない。
外筒内とガスケットとの密着は,外筒の目盛範囲を超えても滑らかに動くものとする。
7
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
12 筒先
12.1 テーパの合致
注射筒形式1,2,3及び4の注射筒の筒先のおす(雄)テーパは,JIS T 3210の12.1(テーパの合致)
に適合しなければならない。
12.2 筒先の位置
注射筒の筒先の位置は,外筒の中心軸とする。
13 針管及び注射針
13.1 注射筒形式3及び4の注射針
注射筒形式3及び4の注射針は,JIS T 3209の箇条4(物理的要求事項),箇条5(化学的要求事項),箇
条8(寸法の許容差),箇条10(針基のテーパの合致),箇条11(構成及び各部の名称),箇条12(針先)
及び箇条13(性能)に適合しなければならない。
13.2 注射筒形式5,6,7及び8の針管
注射筒形式5,6,7及び8の針管の材料は,JIS T 3209の11.2(材料)による。針管全体の管径が均一
のものは,JIS T 3209の箇条8(寸法の許容差),箇条12(針先),13.3(弾性)及び13.4(曲げ強さ)に
適合するか,又はISO 9626の8(寸法),9(剛性)及び10(破壊抵抗)に適合しなければならない。非円
筒形の針管は,JIS T 3209の箇条8のb)及び箇条12に適合し,かつ,刃面直前の管径を測定したときJIS
T 3209の箇条8のa)に適合しなければならない。
針管と針基又は注射筒との接合強度は,JIS T 3209によって試験したとき,22 N 以上でなければならな
い。
14 注射筒組立品の性能
14.1 デッドスペース
附属書Cによって試験したとき,デッドスペースは表2の限界を超えてはならない。
表2−最大デッドスペース
注射筒の形式
最大デッドスペース
mL
1及び2
0.07
3及び4
0.10
5及び6
0.02
7及び8
0.01
14.2 針の漏れ
附属書Dによって試験したとき,D.2.9に規定した接合部から30秒以内にしずくが落下するような水の
漏れがあってはならない。
附属書Eによって試験したとき,E.2.6に規定した接合部から連続した気泡の形成があってはならない。
14.3 ガスケットを通した液及び空気の漏れ
附属書Dによって試験したとき,ガスケットのシール部分を通して水の漏れがあってはならない。
附属書Eによって試験したとき,ガスケットのシール部分を通して連続した気泡の形成があってはなら
ない。
8
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
15 無菌性の保証
無菌性の保証は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行う。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
16 生物学的安全性
JIS T 0993-1に規定する生物学的安全性の評価を行う。
17 エンドトキシン
注射筒10本(注射針がある場合は,注射針を付ける。)をとり,公称容量目盛の位置までエンドトキシ
ン試験用水を吸い入れ,各注射筒のそれぞれの筒口を密封してよく振り混ぜた後,室温で1時間放置し,
この液を試験液とする。日局のエンドトキシン試験法によって試験したとき,エンドトキシン含量が
0.5 EU/mL未満であるか,又はこれと同等以上の基準に適合しなければならない。
18 包装
18.1 一次包装及びセルフコンテインドシリンジユニット
18.1.1 一般
注射筒形式1,3,5及び7は一次包装で包装し,注射筒形式2,4,6及び8はセルフコンテインドシリ
ンジユニットで包装する。
18.1.2 一次包装(注射筒形式1,3,5及び7)
注射筒(針付きも含め)を供給するときは,一次包装ごとに封をしなければならない。
注射筒形式3,5及び7の針は,針さや(鞘)で保護した状態で供給しなければならない。
注射筒形式3の針は一次包装の中にあり,それ自身の容器で包装する。
一次包装の材料及び設計は,内容物に有害な結果を与えず,かつ,次のことを保証しなければならない。
a) 乾いた,清潔なそして十分に検証された保管条件下で,容器の無菌性を維持する。
b) 開封まで及び容器から取り出すまで,内容物の汚染のリスクは最小とする。
c) 通常の取扱い,輸送及び保管の間,内容物は適切に保護されている。
d) 一度開封したら,簡単に再シールできず,かつ,開封されたことが容易に分かる。
18.1.3 セルフコンテインドシリンジユニット(注射筒形式2,4,6及び8)
注射筒には,保護用先端キャップ及び保護用キャップが取り付けられていなければならない。
注射筒単位の材料及び設計は,次のことを保証しなければならない。
a) 乾いた,清潔なそして十分に検証された保管条件下で,注射筒単位の内側の無菌性を維持する(例え
ば,針の外側の表面,押子のはみ出している部品,プッシュボタン,注射筒の液体の通路及び針が付
いている場合の針)。
b) 開封まで,内容物の汚染のリスクは最小とする。
c) 通常の取扱い,輸送及び保管の間,内容物は適切に保護されている。
18.2 多数本入り包装(注射筒形式2,4,6及び8)
多数本入り包装は,注射筒形式2,4,6及び8の注射筒単位を12を超えて入れてはならない。
多数本入り包装の材料及び設計は,次のことを保証しなければならない。
a) 開封まで,内容物の汚染のリスクは最小とする。
b) 通常の取扱い,輸送及び保管の間,内容物は適切に保護されている。
9
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
c) 一度開封したら,多数本入り包装が開封されたことが容易に分かる。
18.3 二次包装
複数の一次包装若しくはセルフコンテインドシリンジユニット,又は複数の多数本入り包装は,二次包
装によって保護する。この包装(容器)は,取扱い,輸送及び保管中に,内容製品を保護するために十分
な強度をもつものとする。
19 表示
19.1 一般
インスリン濃度の指示にカラーコードを用いる場合は,オレンジ色をU-100注射筒に用いる。オレンジ
の色は,インスリン以外の表示に用いてはならない。
カラーコードを使用する場合は,注射筒の保護用先端キャップを含め全ての包装に示す。
19.2 注射筒
19.2.1 一般
注射筒の外筒には,次の情報を表示する。
a) 箇条8及び箇条9に従った適切な目盛スケール
b) “U-100インスリン”又は“U-100 insulin”のいずれか。ただし,U-は“単位”でもよい。
c) “units”,“I.U”又は“単位”
d) ミリリットル(mL)で全目盛容量
19.2.2 セルフコンテインドシリンジユニット(注射筒形式2,4,6及び8)に対する追加の表示
注射筒又は注射筒単位へ,更に次の情報を表示する。
a) “再使用禁止”の旨(ただし,“ディスポーザブル”の表現は使用しない。)
b) 製造販売業者の名称及び/又は商標
外筒に表示する全ての情報は,目盛スケールの読みをできる限り妨げない位置とする。
19.3 一次包装(注射筒形式1,3,5及び7)
一次包装は次の事項を表示する。
a) 注射針が入っている又は針管が付いている場合には,針管の外径(mm)及び長さ(mm)
b) “滅菌済み”の旨
c) 製造番号又は製造記号
d) 注射筒の容量及び使用するインスリンの濃度
19.4 多数本入り包装(注射筒形式2,4,6及び8)
多数本入り包装は,次の情報を表示する。
a) “注射筒内部滅菌済み”の旨
b) “再使用禁止”の旨(ただし,“ディスポーザブル”の表現は使用しない。)。
c) 製品に情報が表示されていないか,又は多数本入り包装を透かして情報が見えない場合には,製造販
売業者の名称及び/又は商標。
d) 製造番号又は製造記号
e) 注射針が入っている又は針管が付いている場合には,針管の外径(mm)及び長さ(mm)
f)
多数本入り包装を透かして情報が見えない場合には,注射筒の容量及び使用するインスリンの濃度を
含む,内容物の表示をする。

10
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
19.5 二次包装
二次包装には,次の事項を表示する。ただし,二次包装を用いないで,一次包装又は多数本入り包装を
最小販売単位の包装として用いる場合には,次の事項を一次包装又は多数本入りに表示する。ただし,i)
及びj)については,製造番号又は製造記号が滅菌年月を表示している場合は,改めて滅菌年月の表示は必
要ない。また,滅菌年月の代わりに使用期限を表示してもよい。
a) 製造販売業者の氏名又は名称,及び住所
b) 承認番号
c) 販売名
d) 注射針が入っている又は針管が付いている場合は,針管の外径(mm)及び長さ(mm)
e) 注射筒包装形式に適切な,“滅菌済み”の旨又は“注射筒内部滅菌済み”の旨
f)
注射筒の容量及び使用するインスリンの濃度
g) 数量(入り数)
h) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
i)
製造番号又は製造記号
j)
滅菌年月
19.6 図記号の使用
箇条19の要件は,JIS T 0307に規定する適切な図記号を使用することによってこれに替えてもよい。
注記 JIS T 0307に規定する主な図記号の例を,表3に示す。
表3−JIS T 0307に規定する主な図記号の例
11
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
pH及び抽出物の試験液
10本の滅菌済み注射筒を,また,針が付いている場合は針も含め,新鮮な精製水で公称容量まで満たす。
その後37
3
0
+ ℃で8時間維持した後,ほうけい酸ガラス製容器内へ内容物を排出し,それらを混合し,室
温まで冷却し,この液を試験液とする。
未使用の精製水の一部で空試験液を準備する。
12
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B
(規定)
押子を操作したときに要求する力の試験方法
B.1
試験方法
B.1.1 この試験は,全ての注射筒に適用する。注射針の付いていないものは注射針を付けて試験する。形
式1及び2の注射筒は,外径0.40 mmの注射針を接続する。
B.1.2 注射筒に,それの表示された容量の50 %の水を満たす。
B.1.3 注射筒の針先を下にして適切な試験用スタンドに固定する。
B.1.4 針先から全ての水を拭き取る。
B.1.5 直ちに,力を測定できる手段によって,押子に対して垂直の下方に向けた力を加える。その後,押
子が動くまで徐々に力を増加する。押子の最初の動きは針から水が排出することで示される。
B.1.6 完全に押し下げるまで,押子の動きを維持するのに十分な力を持続する。
B.1.7 試験の間の,押子の操作に要した最大の力を記録する。
B.2
試験報告書
試験報告書には,次の情報を記載する。
a) 注射筒のロット
b) 試験日
c) 押子の最初の動きに要した力。ニュートン(N)で表す。
13
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C
(規定)
デッドスぺースの測定方法
C.1 試料の調整
C.1.1 注射筒形式3及び4
注射針が付いている場合,注射筒から注射針を取り外し,次のように再接続する。
注射筒の筒先へ針基を接続する。構成部品は27.5 Nの力を5秒間軸方向にかけ組み立てる。この間,ね
じりトルク力0.1 N・mを超えず,そして,90°を超える回転をかけないねじり操作を加える。
C.1.2 注射筒形式1,2,5,6,7及び8
調整の必要はない。
C.2 手順
C.2.1 針が装着している場合,針を含め用いる注射筒の質量を,C.1に従い0.001 g単位まで計測する。
C.2.2 20±3 ℃の精製水で全目盛容量まで注射筒を満たす。全ての気泡を追い出す。特に,針がある場合
には,針の中からも追い出す。そして,針のない注射筒の場合は,筒先の開くう(腔)の端と一致した液
面の水平を確実にする。
C.2.3 押子を一杯まで押し下げ水を排出する。その後,注射筒の外表面を拭いて乾燥する。
C.2.4 注射筒を再ひょう量する。
C.3 結果の計算
水を排出した後の注射筒の質量から用いた注射筒の質量を減じ,注射筒に残った水の質量をグラム単位
で測定する。水の比重を1 000 kg/m3として用い,デッドスペースの容量をミリリットル(mL)で記録す
る。
C.4 試験報告書
試験報告書には,次の情報を記載する。
a) 注射筒のロット
b) 試験日
c) ミリリットル(mL)で表した,注射筒のデッドスぺース
14
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書D
(規定)
圧力下における注射筒のガスケットと外筒との接触部及び
注射筒の筒先と針基又は針と外筒との接合部の液漏れの試験方法
D.1 試料の調整
D.1.1 ガスケットを通過する漏れの試験
D.1.1.1 一般
D.1.1.2〜D.1.1.5に従い,試験試料を調整する。
D.1.1.2 注射筒形式1及び2の場合
注射筒の筒先へISO 594-1で規定する標準めす(雌)かん(嵌)合具(Reference steel female conical fitting)
を接続する。両方の組立用構成部品は乾燥しておく。構成部品の組立ては,27.5 Nの力を5秒間軸方向に
かけ組み立てる。この間,力を加えてねじる操作は,ねじりトルク力0.1 N・mを超えず,そして,90°を
超える回転をかけないで行う。
D.1.1.3 注射筒形式3及び4の場合
注射針が付いている場合,注射針を取り外し,D.1.1.2の規定と同様に,注射筒の筒先へ標準めす(雌)
かん(嵌)合具を接続する。
D.1.1.4 注射筒形式5及び6の場合
注射筒の筒先と針基との間の接続は,しっかりと組み立て,漏れがない状態とする。
D.1.1.5 注射筒形式7及び8の場合
調整の必要はない。
D.1.2 注射筒筒先の漏れ試験
D.1.2.1 一般
D.1.2.2〜D.1.2.5に従い,試験試料を調整する。
D.1.2.2 注射筒形式1及び2の場合
D.1.1.2の規定と同様に,注射筒の筒先へ標準めす(雌)かん(嵌)合具を接続する。
D.1.2.3 注射筒形式3及び4の場合
針が付いている場合,針を取り外し,D.1.1.2の規定と同様に,注射筒の筒先へ標準めす(雌)かん(嵌)
合具を接続する。
D.1.2.4 注射筒形式5及び6の場合
調整の必要はない。
D.1.2.5 注射筒形式7及び8の場合
調整の必要はない。
D.2 手順
D.2.1 注射筒の目盛容量を超える量の水を注射筒ヘ吸引する。注射筒の筒先と標準めす(雌)かん(嵌)
合具との接続部,又は注射筒と針管との接続部がぬれている場合は,接続部を乾燥する。
D.2.2 空気を追い出す。
D.2.3 注射筒の最大目盛となるように注射筒内の水の量を調整する。
15
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
D.2.4 標準めす(雌)かん(嵌)合具,又は針先を適切に封をする。
D.2.5 押子の軸方向に直角の角度でプッシュボタンに対し,0.25 N(25.5 g)の負荷を加え,ガスケット
のシールの周りに,押子の半径に沿って押子を振る。押子の方向は,軸の位置から最大の振れにしておく。
D.2.6 ガスケットと外筒との交互作用によって圧力を生じさせるために注射筒に対して軸方向に300 kPa
の力を加える。圧力は30秒間加える。
D.2.7 圧力をかけている間,試験している注射筒の全ての部分について漏れの有無を観察し,記録する。
D.2.8 ガスケットのシールを通して液漏れがないか注射筒を試験する。
D.2.9 注射筒筒先と標準めす(雌)かん(嵌)合具若しくは針基との接続部,又は注射筒と針管との接合
部の液漏れがないか試験する。
D.3 試験報告書
試験報告書には,次の情報を記載する。
a) 注射筒のロット
b) 試験日
c) 押子先端を通しての漏れの有無の観察の結果
d) D.2.9の規定による,漏れの有無の観察の結果
16
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書E
(規定)
減圧下における筒先と針基又は針と外筒との接合部及び
ガスケットと外筒との接触部の空気漏れの試験方法
E.1
試料の調整
D.1に規定したように試験試料を調整する。
E.2
手順
E.2.1 注射筒に,煮沸し冷却した直後の水を注射筒の公称目盛容量の25 %を下回らない量を吸引する。
注射筒のノズルと標準めす(雌)かん(嵌)合具との接合部,又は注射筒と針管との接合部がぬれている
ときは,接合部を乾燥する。
E.2.2 空気を排出する。ただし,小さな気泡は除外する。
E.2.3 水の量を注射筒の公称目盛容量の25 %に調整する。
E.2.4 注射筒の筒先を下にして,先端を閉塞した後,押子を全目盛容量線まで引く。15秒間保持する。
E.2.5 E.2.4の試験後,押子を元に戻し筒内に空気のないことを確認し,注射筒の筒先を上にして,押子
を全目盛容量線まで引く。15 秒間保持する。
E.2.6 注射筒の筒先と標準めす(雌)かん(嵌)合具若しくは針基の接続部,注射筒と針管との接合部及
び外筒とガスケットとの接触部から気泡が連続して形成されるか試験する。最初の5秒間に現れる気泡は
無視する。
E.3
試験報告書
試験報告書には,次の情報を記載する。
a) 注射筒のロット
b) 試験日
c) E.2.6の規定による,漏れの有無の観察の結果。
17
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
JISと対応国際規格との対比表
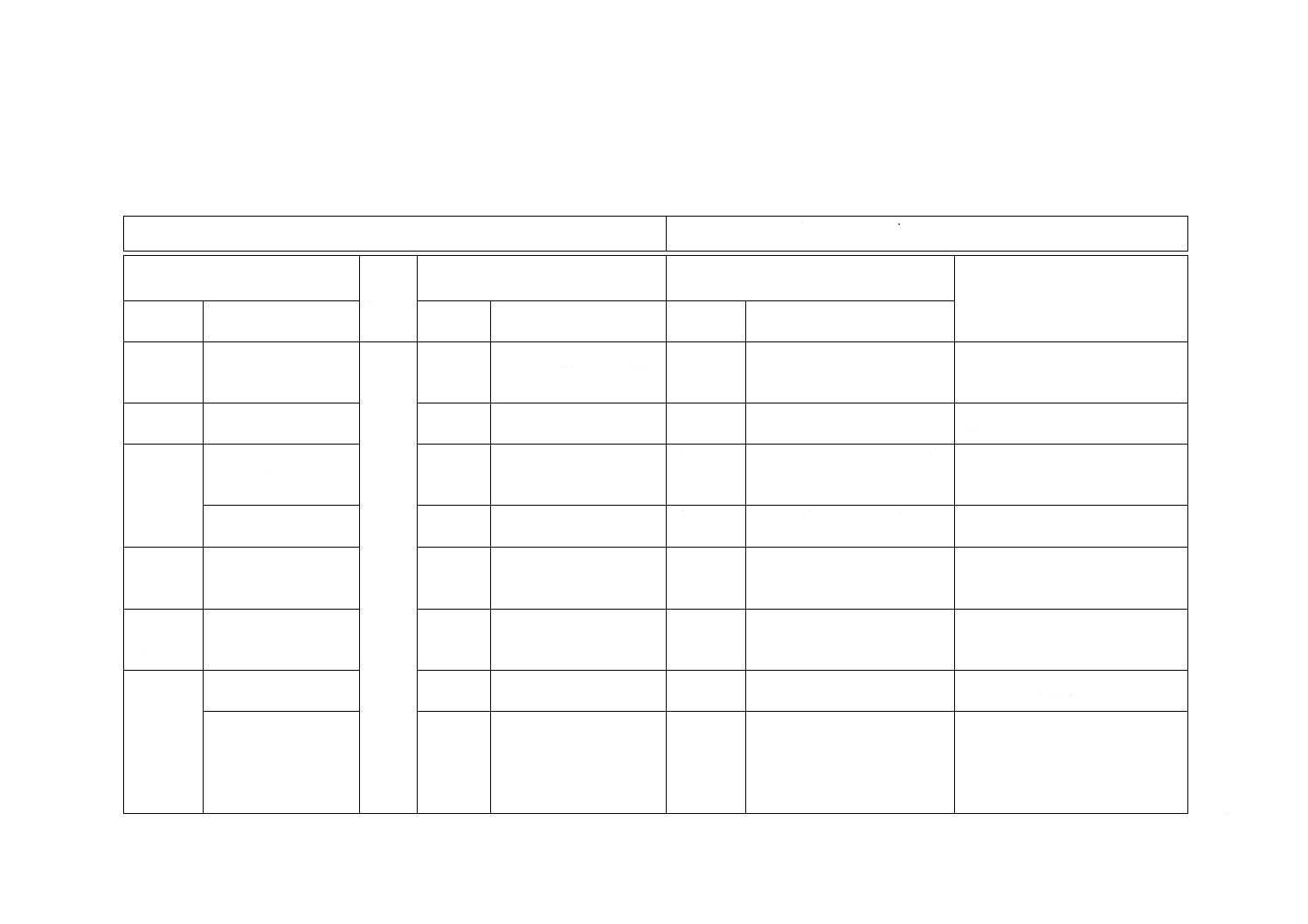
JIS T 3253:2012 インスリン皮下投与用注射筒
ISO 8537:2007 Sterile single-use syringes, with or without needle, for insulin
(I)JISの規定
(II)
国際規
格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
1適用範
囲
インスリン用針なし
又は針付きの単回使
用注射筒
1
40単位及び100単位イン
スリン用針なし又は針付
きの単回使用注射筒。
削除
JISは,100単位だけ規定。
実質的な差異はない。
3 用語及
び定義
15項目の用語の定義
を規定
3
4項目の用語の定義を規
定。
追加
JISは定義が多い。
利用者の利便性のため。実質的な
差異はない。
4構成及
び各部の
名称
インスリン皮下投与
用注射筒の構成及び
各部の名称例を規定
−
−
追加
JISは構成及び各部の名称を解
説。
利用者の利便性のため。実質的な
差異はない。
例図
3
JISとほぼ同じ。
追加
JISは注射針の例図を追加。
利用者の利便性のため。実質的な
差異はない。
7注射筒
及び針の
潤滑剤
7.1潤滑剤の内容規格
を規定
−
−
追加
ISO規格には規定がない。
JISはシリコーン油基準に適合す
るシリコーンを追加。実質的な差
異はない。
8公称容
量の許容
差
U-100の目盛の許容差
を規定
9.1
JISとほぼ同じ。
変更
JISはU-100だけを規定。
JISは厚労省及びWHOの安全指導
に従いU-100だけを規定。実質的
な差異はない。
11ガスケ
ット・押子
の組立
11.1ガスケットと押子
の組立機能を規定
11.1
JISとほぼ同じ。
変更
JISは,ガスケット/押子のか
ん(嵌)合性の試験方法を変更。
JISは実際の操作方法を試験の方
法とした。実質的な差異はない。
11.2ファーストライン
の性能を規定
−
−
追加
ISO規格には規定がない。
ISO規格の2007年版の改正でこの
規定は削除されたが,JISは使用者
の利便性のため旧規格の内容のま
まで残すこととした。実質的な差
異はない。
2
T
3
2
5
3
:
2
0
1
2
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
18
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際規
格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
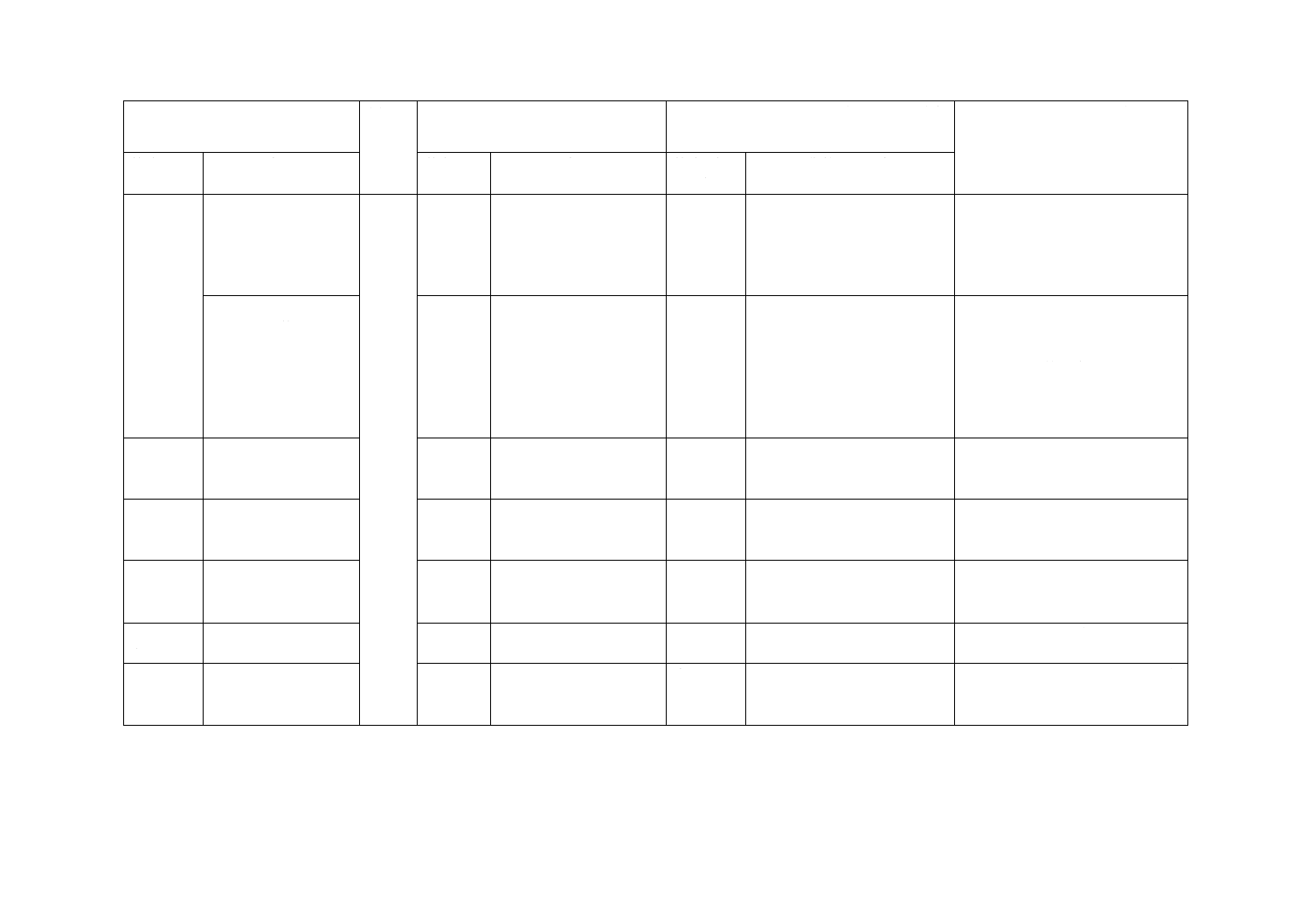
13針管及
び注射針
13.1注射筒形式3及び
4に使用する注射針を
規定
13.1
JISとほぼ同じ。
変更
JISはJIS T 3209に適合する注
射針だけを規定した。
JISは,JIS T 3209に適合する注射
針だけを規定した。JIS T 3209は
ISO 7864を引用しており,この規
格の対応国際規格の引用先と同じ
である。実質的な差異はない。
13.2注射筒形式5,6,
7及び8に使用する針
管を規定
13.2
JISとほぼ同じ。
選択
JISは非円筒形の針管の規定及
びJIS T 3209で規定する針管
の材質のを追加。及び注射筒形
式5,6,7及び8の針管/注射
筒の接合強度を此処で規定。
JISは非円筒形の針管の規定し,
JIS間の整合性を取るためJIS T
3209に適合する針管も選択可能と
した。また,筒形式5,6,7及び8
の針管/注射筒の接合強度は,ISO
規格の附属書Dからこの項目へ移
動した。実質的な差異はない。
14注射筒
組立品の
性能
14.3ガスケットを通し
た漏れを規定
14.3
JISとほぼ同じ。
変更
ISOは空気の漏れ試験を類似
した2方法で実施するが,JIS
は1方法とした。
JISは利用者の利便を図るために,
1方法の試験をすればよいことに
した。実質的な差異はない。
15無菌性
の保証
無菌性の保証方法を
規定
−
−
追加
JISは,我が国で実績のある方法を
追加した。ISO規格は前文に記載
があり実質的な差異はない。
16生物学
的安全性
生物学的安全性の確
認方法を規定
−
−
追加
JISは,我が国で実績のある方法を
追加した。ISO規格は前文に記載
があり実質的な差異はない。
17エンド
トキシン
エンドトキシンの確
認方法を規定
−
−
追加
JISは,我が国で実績のある方法を
追加した。実質的な差異はない。
19表示
19.1カラーコードを用
いる場合について規
定
16
JISとほぼ同じ。
変更
JISはU-100だけを規定。
JISは厚労省及びWHOの安全指導
に従いU-100だけを規定。実質的
な差異はない。
2
T
3
2
5
3
:
2
0
1
2
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
19
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際規
格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
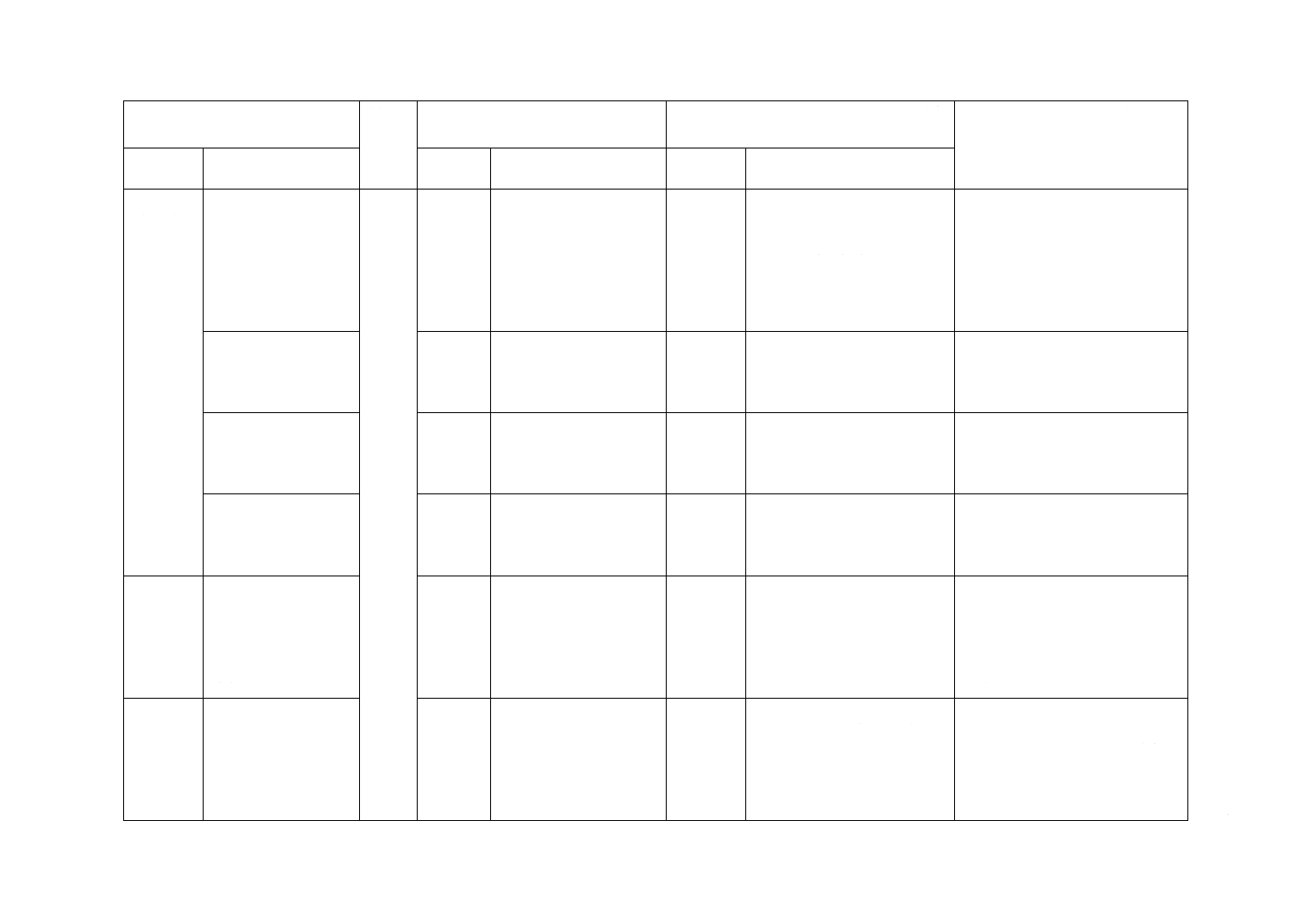
19表示
(続き)
19.2注射筒の表示事項
を規定
16.1
JISとほぼ同じ。
変更
JISは破損に関する注意事項及
びシンボルマークの使用をこ
の項から削除。及び,U-40に
関する記述も削除。
JISは包装の破損に関する注意事
項を削除(添付文書に記載される
ため)。シンボルマークの使用は単
独の項目を設けそちらへ移動。厚
労省及びWHOの安全指導に従い
U-100だけを規定。実質的な差異
はない。
19.3一次包装の表示事
項を規定
16.2
JISとほぼ同じ。
変更
JISは破損に関する注意事項及
びシンボルマークの使用をこ
の項から削除。
JISは包装の破損に関する注意事
項を削除(添付文書に記載される
ため)。シンボルマークの使用は単
独の項目を設けそちらへ移動。
19.4多数本入り包装の
表示事項を規定
16.3
JISとほぼ同じ。
変更
JISは破損に関する注意事項及
びシンボルマークの使用をこ
の項から削除。
JISは包装の破損に関する注意事
項を削除(添付文書に記載される
ため)。シンボルマークの使用は単
独の項目を設けそちらへ移動。
19.5二次包装の表示事
項を規定
16.4
JISとほぼ同じ。
変更
JISは破損に関する注意事項及
びシンボルマークの使用をこ
の項から削除。
JISは包装の破損に関する注意事
項を削除(添付文書に記載される
ため)。シンボルマークの使用は単
独の項目を設けそちらへ移動。
附属書E
(規定)
減圧下における筒先
と針基又は針と外筒
との接合部及びガス
ケットと外筒との接
触部の空気漏れの試
験方法
Annex G
JISとほぼ同じ。
追加
ガスケットと外筒との接合部
の空気漏れ。
JISはISO規格の附属書Bで行う,
ガスケットと外筒との接触部の空
気漏れの確認を附属書Eの試験時
に,同時に行うこととし,ISO規
格の附属書Bを削除した。実質的
な差異はない。
−
−
Annex B
(規定)減圧下における
注射筒のガスケットから
の空気漏れの試験方法
削除
JISは,附属書Eの試験時にガ
スケットからの漏れを確認す
る。
JISは附属書Eの試験時にガスケ
ット及びガスケット外筒からの漏
れを確認できることから,利便性
のため類似の試験の重複を避ける
ためAnnex Bを削除。実質的な差
異はない。
2
T
3
2
5
3
:
2
0
1
2
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
20
T 3253:2012
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際規
格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差異
の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
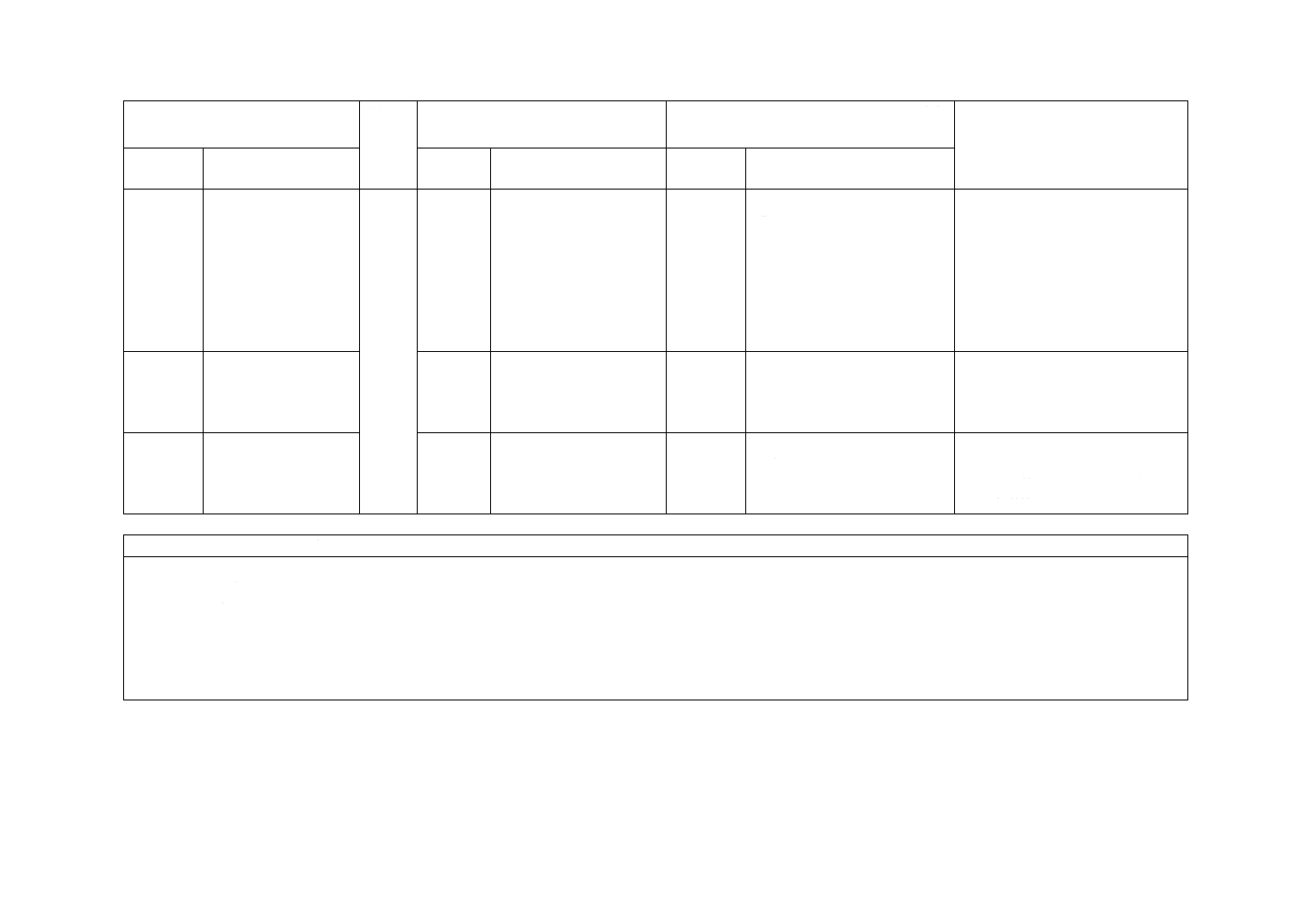
−
−
Annex D
(規定)針管の物理的特
性を規定。
削除
JISは,附属書でなく,本体で
ISO 9626に従うと規定。
JISは,Annex Dを削除し,ISO
9626に従うことと本体に記載し
JIS T 3209に適合する針管も選択
可能とした。又注射筒形式5,6,7
及び8の針管/注射筒の接合強度
は13針管及び針へ規定を変えず移
動した。したがって実質的には内
容の変更ではない。
−
−
Annex H
(参考)発熱性及び毒性
試験の抽出液の調製
削除
JISは,附属書でなく,本体で
規定。
JISは箇条16でJIS T 0993-1に規
定する生物学的安全性の評価を行
うこととした。実質的な差異はな
い。
−
−
Annex J
(参考)再使用禁止の記
号
削除
JISは,附属書でなく,本体で
規定。
JISは19.6で再使用禁止の記号も
含め,JIS T 0307に規定する適切
な記号を使用することを可能とし
た。実質的な差異はない。
JISと国際規格との対応の程度の全体評価:ISO 8537:2007,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除……………… 国際規格の規定項目又は規定内容を削除している。
− 追加……………… 国際規格にない規定項目又は規定内容を追加している。
− 変更……………… 国際規格の規定内容を変更している。
− 選択……………… 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2
JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD…………… 国際規格を修正している。
2
T
3
2
5
3
:
2
0
1
2
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。