T 3233:2011
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲 ························································································································· 1
2 引用規格 ························································································································· 1
3 用語及び定義 ··················································································································· 1
4 構成及び各部の名称 ·········································································································· 3
5 材料······························································································································· 3
6 容量······························································································································· 3
7 設計······························································································································· 3
8 構造······························································································································· 4
9 無菌性の保証 ··················································································································· 4
10 添加物 ·························································································································· 4
11 表示及びラベリング ········································································································ 4
11.1 管 ······························································································································ 4
11.2 一次包装 ····················································································································· 5
11.3 記号の使用 ·················································································································· 5
附属書A(規定)減圧された容器の吸引量試験及び最小フリースペース試験 ···································· 7
附属書B(規定)容器の漏れ試験····························································································· 9
附属書C(規定)容器の強度試験 ··························································································· 10
附属書D(参考)添加物の濃度及び液体添加物の量···································································· 11
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 13
T 3233:2011
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,日本医療器材工業
会(JMED)及び財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を改正すべきと
の申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正した日本工業規格である。
これによって,JIS T 3233:2005は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3233:2011
真空採血管
Evacuated single-use containers for venous blood specimen collection
序文
この規格は,1995年に第1版として発行されたISO 6710を基とし,我が国の実情に合わせるため,真
空採血管の部分だけを抜き出し技術的内容を変更して作成した日本工業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格を変更している事項である。変更の一
覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,静脈血採集用容器であってあらかじめ採血量分減圧されており,そのまま直ちに使用でき,
かつ,単回使用で滅菌済みの真空採血管(以下,真空採血管という。)について規定する。
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 6710:1995,Single-use containers for venous blood specimen collection(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
なお,平成26年7月28日までJIS T 3233:2005は適用することができる。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,記載の西暦年の版を適用し,その後の改正版(追補を含む。)は適用しない。
JIS T 0307:2004 医療機器−医療機器のラベル,ラベリング及び供給される情報に用いる図記号
ISO 594-1:1986,Conical fittings with a 6 % (Luer) taper for syringes, needles and certain other medical
equipment−Part 1: General requirements
ISO 3696:1987,Water for analytical laboratory use−Specification and test methods
ISO 11137:2006 (all parts),Sterilization of health care products−Radiation
ISO 17665-1:2006,Sterilization of health care products−Moist heat−Part 1: Requirements for the
development, validation and routine control of a sterilization process for medical devices
ISO/TS 17665-2:2009,Sterilization of health care products−Moist heat−Part 2: Guidance on the application
of ISO 17665-1
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
2
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.1
採血管(container)
所定の栓が付いた血液検体を入れる容器。
3.2
真空採血管(evacuated container)
血液を採取するために,あらかじめ製造販売業者によって減圧された状態にある容器。
3.3
管(tube)
採血管の部品で,栓のない検体容器。
3.4
栓(closure)
採血管を密封するための構成部品。
3.5
一次包装(primary pack)
採血管を直接覆う包装。通常,複数の容器,例えば,100本を入れる販売最小単位のものをいう。真空
採血管を減圧の保持,保湿,遮光などの目的で包装し,その後更に一次包装する場合は,減圧の保持等が
目的の包装は内袋であり,一次包装には該当しない。
3.6
内面(container interior)
採血管の内側の表面。
3.7
添加物(additive)
目的とした分析を実施可能にするために,採血管内に加えられる物質(採血管の内面に除去できないよ
うに処理されたものを除く。)。
3.8
公称容量(nominal capacity)
採血管に採取する予定の血液量。
3.9
フリースペース(free space)
採血管の中身を適切に混合することを考慮した,余剰容量又はヘッドスペースで,附属書Aで規定され
た最小フリースペース試験で測定したもの。
3.10
吸引量(draw volume)
真空採血管の公称容量。
3.11
使用期限(expiry date)
表示年月以降は,この規格の要求に適合しないと製造販売業者が主張する日付。
3.12
目視検査(visual inspection)
300 lx〜750 lxの均一の照明下で,拡大鏡を用いないで,正常又は正常に補正された矯正視力で行う観察
3
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
検査。
4
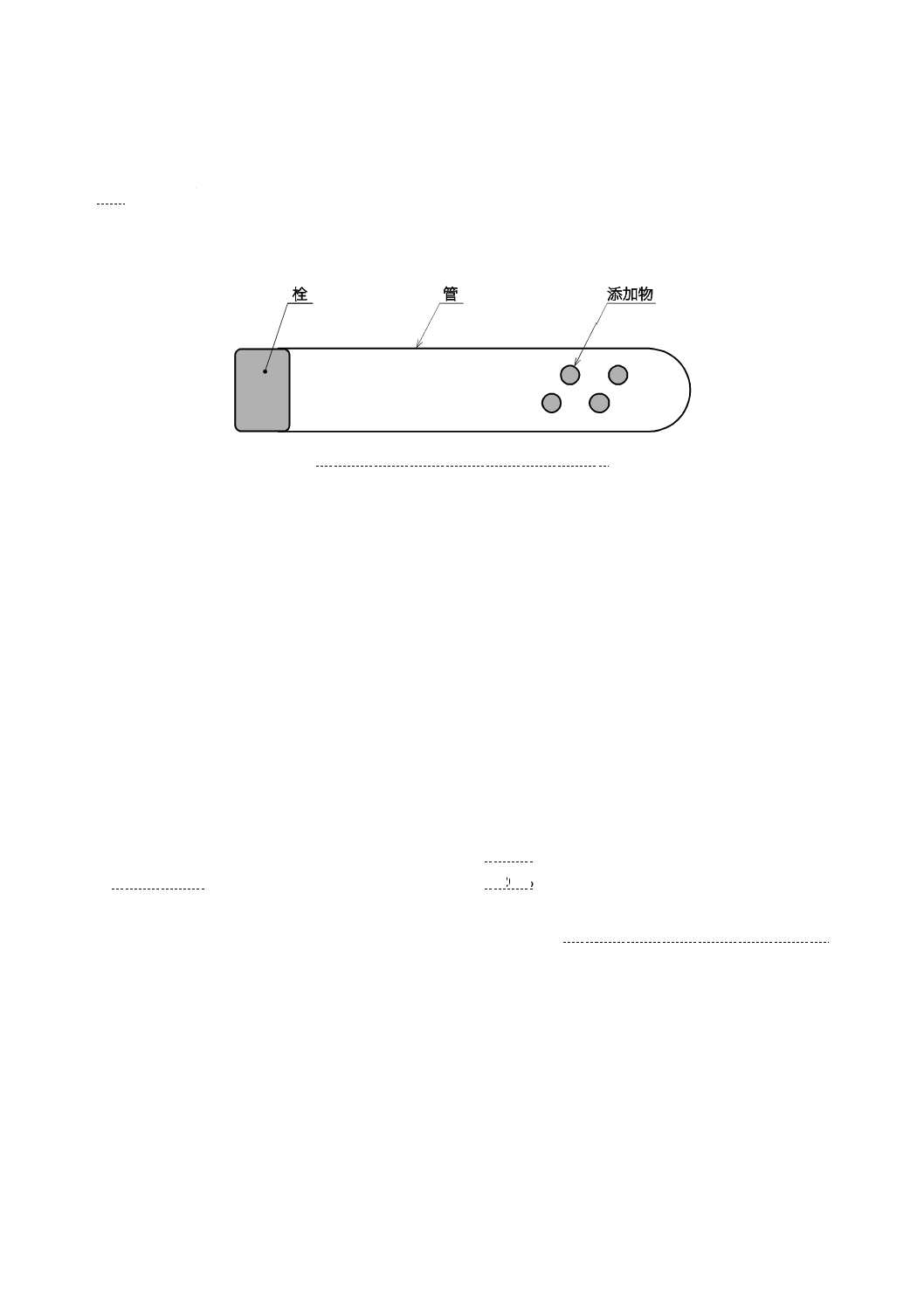
構成及び各部の名称
真空採血管は,管及び栓からなり,使用目的によって添加物を添加したものもある。
一般的な真空採血管を図1に例示する。
図1−真空採血管の構成及び各部の名称例
5
材料
5.1
管は,目視検査で内容物が明瞭に見える材料で作らなければならない。
血液凝固試験に対する検体を収容するガラス管の内面は,凝固促進作用を起こさない物質にするのがよ
い(参考文献[1]参照)。
5.2
採血管が特定の物質の測定を目的とする場合には,製造販売業者は,その物質による採血管内部の
汚染の最大レベル及び用いる分析方法を,添付文書,ラベル又は包装容器に記載しなければならない(11.2
参照)。特別の金属及び特別な物質の測定には,栓の配合剤の分析への妨害及び結果への影響があってはな
らない。
5.3
目視検査をしたとき,採血管内部に異物があってはならない。
6
容量
6.1
附属書Aに規定する方法によって試験したとき,ビュレットから加えた,又は出した水の量は公称
容量に対し,次の範囲内にあるのがよい。
添加物が液体で添加量が試験結果に影響する場合 ±10 %
その他の場合 ±20 %
6.2
添加物入り容器に対しては,附属書Aに規定する方法によって試験したとき,機械又は手動の方法
で適切な混合ができる十分なフリースペースがなければならない。最小フリースペースは,採血管の公称
容量を採血しても内容物が十分かくはんできるものでなければならない。余裕は,容器の内容物の混合に
対し役立つフリースペースとして栓の下側と液表面とに挟まれた部分とする。
7
設計
7.1
栓は,附属書Bに規定する方法によって漏れ試験を行ったとき,混合の間,漏れがあってはならな
い。
7.2
栓が,採血管の内容物を取り扱う場合,取り外すように設計されているときは,指でつかむ及び/
又は道具を使う方法で取り外すことができ,このとき検体と接触した栓部分が指に触れ,指が汚染される
ことがないように設計されていなければならない。
4
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注記 幾つかの分析機器(例えば血球計数器)は,栓を取り外すことなく血液標本容器の内容物を吸
引可能なように設計されている。
7.3
容器は,附属書Bに規定する方法によって漏れ試験を行ったとき,採血管を沈めた水は蛍光を発し
てはならない。
8
構造
8.1
附属書Cに規定する方法によって試験したとき,検体が入った採血管は,長軸方向の3 000 gの加速
度に耐えなければならない。
注記 g=9.806 65 m/s2
8.2
目視検査を行ったとき,使用者の皮膚を偶発的に切る,刺す及びすりむく可能性のある鋭利なエッ
ジ,突起物又は表面に凹凸があってはならない。
9
無菌性の保証
製造販売業者は,未開封及び未使用の採血管の内部及び全ての容器内の内容物が滅菌されることを確実
にする工程を滅菌バリデーション基準又はISO 11137規格群若しくはISO 17665規格群に従って設計しな
ければならない。滅菌保証レベルはSAL 10−3以上とする。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
10 添加物
10.1 添加物の公称量は,附属書Dの範囲内にあるのがよい。
10.2 採血管内の液体添加物の量は,質量測定を行い液体の密度で補正しなければならない。
11 表示及びラベリング
11.1 管
11.1.1 ラベルを貼る場合は,管全体を囲まない。
11.1.2 ラベル(貼られて出荷されるもの)及び表示は,4±1 ℃の空気中で48時間以上さらされた後,付
着力が残らなければならない。
注記 この箇条は,通常の条件下での製品に対する要求事項である。しかし,製品は,極端な条件下
(例えば,極端な温度若しくは湿度,又は異常な輸送若しくは長期間の保管)で保管又は使用
される場合には,この要求は不適切である。製品が,製造販売業者が極端又は異常な条件下で
の保管又は使用に適していると主張する場合は,製造販売業者がその主張に対し責任を負う。
11.1.3 管又はラベルに直接,次の事項を表示するのがよい。
a) 製造販売業者の氏名又は名称若しくは商標
b) 製造番号又は製造記号
c) 文字コード(表2参照)及び/又は内容物の記述
d) 使用期限
e) 公称容量
f)
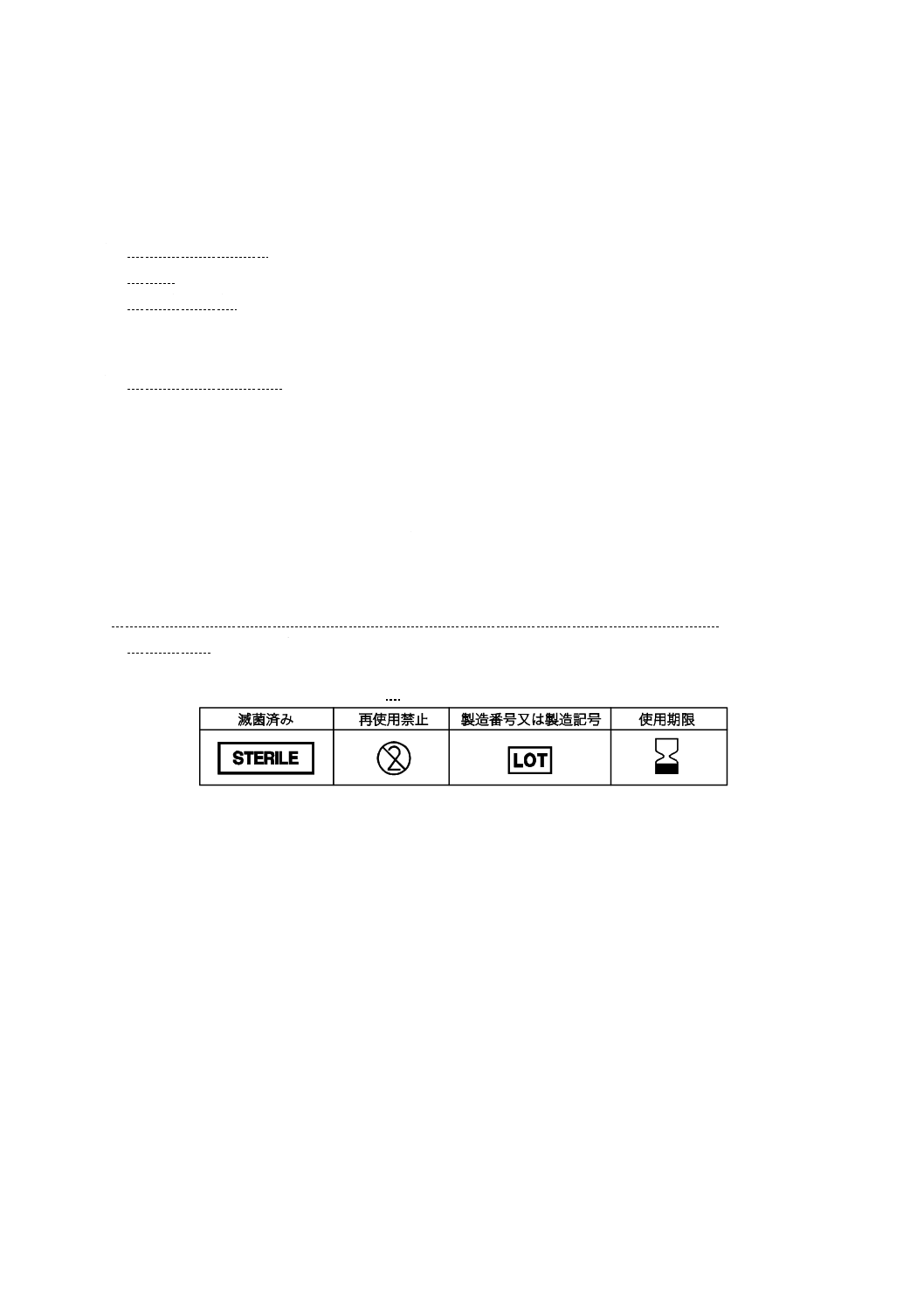
“滅菌済み”の旨
11.1.4 カラーコード
カラーコードを用いる場合は,管,ラベル,栓などに表2に記載する色で着色をするのがよい。
5
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11.2 一次包装
一次包装には,次の事項を表示する。ただし,一次包装を用いないで,内袋を最小販売単位として用い
る場合には,次の事項を内袋に表示する。
a) 製造販売業者の氏名又は名称,及び住所
b) 医療機器の認証番号
c) 販売名
d) 数量(入り数)
e) “滅菌済み”の旨
f)
“再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
g) 製造番号又は製造記号
h) 使用期限
i)
内容物の記載
− 公称容量
− 添加物の名称又は組成
− 保管条件
j)
特定物質の定量のために準備された採血管であり,その物質による容器内の汚染レベルを保証する場
合は,その物質による汚染の最大レベルをラベル又は一次包装へ記載しなければならない。
11.3 記号の使用
11.2はJIS T 0307に規定する適切な記号を使用することによってこれに替えてもよい。
注記 JIS T 0307に規定する主な記号の例を,表1に示す。
表1−JIS T 0307に規定する主な記号の例

6
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表2−推奨する識別のための文字コード及びカラーコード
添加物
文字コード
カラーコード
EDTAa) 二カリウム塩
三カリウム塩
二ナトリウム塩
K2E
K3E
N2E
ラベンダ
ラベンダ
ラベンダ
くえん酸三ナトリウム 9:1 b)
9NC
ライトブルー
くえん酸三ナトリウム 4:1 b)
4NC
黒
ふっ化物/しゅう酸塩
ふっ化物/EDTA
ふっ化物/ヘパリン
FX
FE
FH
灰色
灰色
緑
ヘパリンリチウム
ヘパリンナトリウム
LH
NH
緑
緑
くえん酸塩,りん酸塩,ぶどう糖,アデニン
CPDA
黄色
なしc)
Z
赤
注記 現在,カラーコードの国際的合意はない。カラーコードを使用するときは,表2の色がよい。
また,カラーコードを用いるのであれば管又はラベルと同じ色の栓色がよい。
注a) EDTAはエチレンジアミン四酢酸(ethylenediaminetetraacetic acid)の略称で,古い使用者は,正
しい系統的な名前[例えば,(ethylenedinitrilo)/tetraacetic acid]よりもむしろこれを使用している。
b) 血液量と抗凝固剤量(例えば,9容量の血液に1容量のくえん酸)との予定された容量の比を示
す。
c) 容器が血液凝固促進剤入りの場合のコードは,文字コードZ及び赤のカラーコードとともに添
加剤の記載を推奨する。
7
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
減圧された容器の吸引量試験及び最小フリースペース試験
A.1 試薬及び装置
A.1.1 水 20〜25 ℃でISO 3696のグレード3に従う。
A.1.2 ビュレット 50 mL容量で0.1 mL目盛(精度±0.1 mL)が付いていて,下又は横にタップ付のも
の。
A.1.3 透明なシリコーンチューブ(短い) 一方の端にばねクリップが付けられ,他の端をビュレットの
タップに接続する。
A.1.4 採血用針 採血管に適用することを採血管の製造販売業者が推奨するもの。
A.1.5 ホルダ 採血管に適用することを採血管の製造販売業者が推奨するもの。
A.2 吸引量試験
A.2.1 試験条件
A.2.1.1 試験は,101 kPa,20 ℃で実施する。他の条件で行った場合は,条件を補正する。
A.2.1.2 試験をする採血管は,未使用のものでなければならない。
A.2.2 試験方法
A.2.2.1 組立て前で供給されている場合は,製品を組み立てる。製造販売業者の説明に従って,採血用針
をホルダに取り付ける。
A.2.2.2 ビュレットを水で満たす。ビュレットのタブを開き,ばねクリップを通して流し,シリコーンチ
ューブを満たす。ビュレットは0目盛の位置でクリップする。
A.2.2.3 採血用針とホルダとを組み立てた外側の針を,シリコーンチューブの壁面を通し,針が十分シリ
コーンチューブの内部へ入るまで刺し込む。
A.2.2.4 製造販売業者の説明に従って,針とホルダとを組み立てたものへ採血管を結合する。
A.2.2.5 容器が満たされて最低1分間又は製造販売業者が満たされたと規定した状態まで放置する。
A.2.2.6 ビュレットの最も高い水面と±0.1 mLの正確さで採血管の液面を合わせ,吸引量を読む。
A.3 最小フリースペース試験
A.3.1 試験条件
A.3.1.1 試験は,101 kPa,20 ℃で実施する。他の条件で行った場合は,条件を補正する。
A.3.1.2 試験をする採血管は,未使用のものでなければならない。
A.3.2 試験方法
A.3.2.1 ビュレットのタップを閉じたまま,シリコーンチューブを滴下口から外す。その後,必要量の水
を用いてビュレットを満たす。
A.3.2.2 蓋を外した採血管をビュレットの滴下口の下に移動する。
A.3.2.3 採血管の口元まで水を入れる。
A.3.2.4 精度±0.1 mLで入れた水の量を読む。
最小フリースペース計算は,吸引量試験の吸引水量(A.2を参照)をビュレットから排出した水の量か
8
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ら減じて求める。
9
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B
(規定)
容器の漏れ試験
B.1
試薬
B.1.1 溶液 60 g/Lのデキストリン70(CAS番号9004-54-0)又は同等物を含んだ100 mLの0.15 mol/L
塩化ナトリウム(NaCl:CAS番号7647-14-5)溶液へ2.5 gのフルオレセインナトリウム(uranine:CAS
番号518-47-8)を溶解したもの。
B.1.2 イオン交換水 暗室で拡大鏡を用いず,紫外線(B.2.2参照)下で正常又は正常の状態に矯正した
裸眼で見るとき,蛍光を発しない水。
B.2
装置
B.2.1 リザーバ(フルオレセインナトリウム試薬用) 使用に適した長さのプラスチックチューブ(1 m
の適切な)を付けたもの。真空採血管を試験するとき,このチューブは採血用針(製造販売業者が推奨す
る)に連結する。他の容器の試験のときは,このチューブは,硬い素材の中空のチップ[ISO 594-1で採
用される6 %のテーパをもつ円すい(錐)のおす連結器]と連結される。
B.2.2 長波長側の紫外線ライト(UV)源
B.2.3 ローラー形ミキサ,又は容器の製造販売業者が推奨する他のミキサ
B.2.4 トルクレンチ(必要ならば)
B.3
真空採血管の試験手順
B.3.1 リザーバに試薬(B.1.1参照)を満たす。
B.3.2 採血用針をリザーバに付け,採血管を公称容量まで満たす。試薬で容器の表面を汚染しないよう注
意する。採血管が満たされたら,針から採血管を外し,管の外表面及び蓋を試薬の汚染がなくなるまで洗
う。紫外線(B.2.2参照)下で検査する。
B.3.3 容器をローラー形ミキサで2分間回転する。又は採血管の製造販売業者が推奨する方法で混合す
る。100 mL以下のイオン交換水が入った容器(vessel)に採血管を転倒して蓋を完全に覆うように沈める。
15 ℃〜20 ℃で60分放置する。イオン交換水中から容器を取り出し,紫外線(B.2.2参照)下で容器(vessel)
のイオン交換水を検査する。
B.4
試験の判定
蛍光が観察されなければ,容器は合格とする。
10
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C
(規定)
容器の強度試験
C.1 試薬及び装置
C.1.1 試験液 正常な人血と同じ比重をもつもの。
C.1.2 血液試料容器
C.1.3 遠心分離器 採血管の底面に,遠心加速度3 000 gを10分間かけられるもの。
C.2 試験手順
C.2.1 製造販売業者が規定した方法を使い,試験液で採血管を満たす。必要ならば,蓋を外し取り替える。
C.2.2 遠心分離器のバケット内に採血管が正しく装着されていること,及び適切にバランスが取られてい
ることを確認する。
C.2.3 試験液を満たした採血管を遠心する(採血管の底面に遠心加速度3 000 gを10分間かける)。その
後,注意深くラックに置き,目視検査を行う。
C.3 試験の判定
採血管に破損,漏れ又はひびがなければ,素材は合格とする。
11
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書D
(参考)
添加物の濃度及び液体添加物の量
D.1 エチレンジアミン四酢酸(EDTA)の塩 {[CH2N(CH2COOH)2]2:CAS番号60-00-4}
二カリウム塩(CAS番号25102-12-9),三カリウム塩(CAS番号17572-97-3),及び二ナトリウム塩(CAS
番号6381-92-6)の濃度は,血液1 mLに対して無水EDTAとして1.2 mg〜2 mgの範囲内でなければならな
い[EDTAは無水塩として計算する(0.004 11 mol/L〜0.006 843 mol/L)]。実際に使用する塩及び結晶水を
補正するために,適正な許容量を定める必要がある。
D.2 くえん酸三ナトリウム(Na3C6H5O7・2H2O:CAS番号6132-04-3)
D.2.1 くえん酸三ナトリウム溶液の濃度は,0.1 mol/L〜0.136 mol/Lの範囲になければならない。添加剤
の許容誤差は,規定容量の±10 %の範囲内でなければならない。
D.2.2 凝固試験:9容量の血液に1容量のくえん酸三ナトリウム溶液を加えるものとする(参考文献[1]
参照)。
D.2.3 Westergren法による血沈試験:4容量の血液に1容量のくえん酸三ナトリウム溶液を加えるものと
する(参考文献[2]参照)。
D.3 ふっ化物及びしゅう酸
濃度は,血液1 mL当たりしゅう酸カリウム一水和物(CAS番号6487-48-5)1 mg〜3 mg(0.003 934 mol/L
〜0.001 1 mol/L)及びふっ化ナトリウム(CAS番号7681-49-4)2 mg〜4 mg(0.047 6 mol/L〜0.095 2 mol/L)
の範囲内でなければならない。
D.4 ふっ化物及びEDTA
濃度は,血液1 mL当たりEDTA 1.2 mg〜2 mg及びふっ化物2 mg〜4 mgの範囲内でなければならない。
D.5 ふっ化物及びヘパリン
濃度は,血液1 mL当たりヘパリン12〜30国際単位及びふっ化物2 mg〜4 mgの範囲内でなければなら
ない。
D.6 ヘパリンナトリウム(CAS番号9041-08-1)及びヘパリンリチウム(CAS番号9045-22-1)
濃度は,血液1 mL当たり12〜30国際単位の範囲内でなければならない。
D.7 くえん酸塩,りん酸塩,デキストロース,アデニン(CPDA)
D.7.1 組成は,次のとおりでなければならない(参考文献[3]参照)。
くえん酸(無水)(CAS番号77-92-9)
2.99 g
くえん酸三ナトリウム(二水和物)(CAS番号6132-04-3)
26.3 g
りん酸二水素ナトリウム(一水和物)(NaH2PO4/H2O:CAS番号10049-21-5)
2.22 g
デキストロース(一水和物)(CAS番号5996-10-1)
31.9 g
12
T 3233:2011
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
アデニン(C5H5N5:CAS番号73-24-5)
0.275 g
注射用水,十分量
1 000 mL
D.7.2 6容量の血液に1容量のCPDA溶液を加えるものとする。
D.7.3 添加剤の許容誤差は,規定容量の±10 %の範囲内でなければならない。
注記 添加物は,複数の物理的状態,例えば,溶液,溶液に熱を加え乾燥したもの,凍結乾燥体,又
は粉末といった形態をとることができる。濃度範囲は,特にEDTAではこれら形状の溶解率又
は拡散速度によって異なる。
参考文献
[1] Recommended methodology for using WHO International Reference Preparations for Thromboplastin, 1983,
World Health Organization,Geneva, Switzerland
[2] International Committee for Standardization in Haematology, 1977,Recommendation for measurement of
erythrocyte sedimentation rate of human blood, American Journal of Clinical Pathology, 68[4], 1977,
pp.505-507
[3] Anticoagulant Citrate Phosphate Dextrose Adenine Solution, pp.101-102,The United States Pharmacopoeia,
The National Formulary, USP XXII,NF XVII,1990, United States Pharmacopoeial, Convention, Inc.,
Rockville, MD, USA
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
JISと対応国際規格との対比表
JIS T 3233:2011 真空採血管
ISO 6710:1995 Single-use containers for venous blood specimen collection
(I)JISの規定
(II)
国際規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
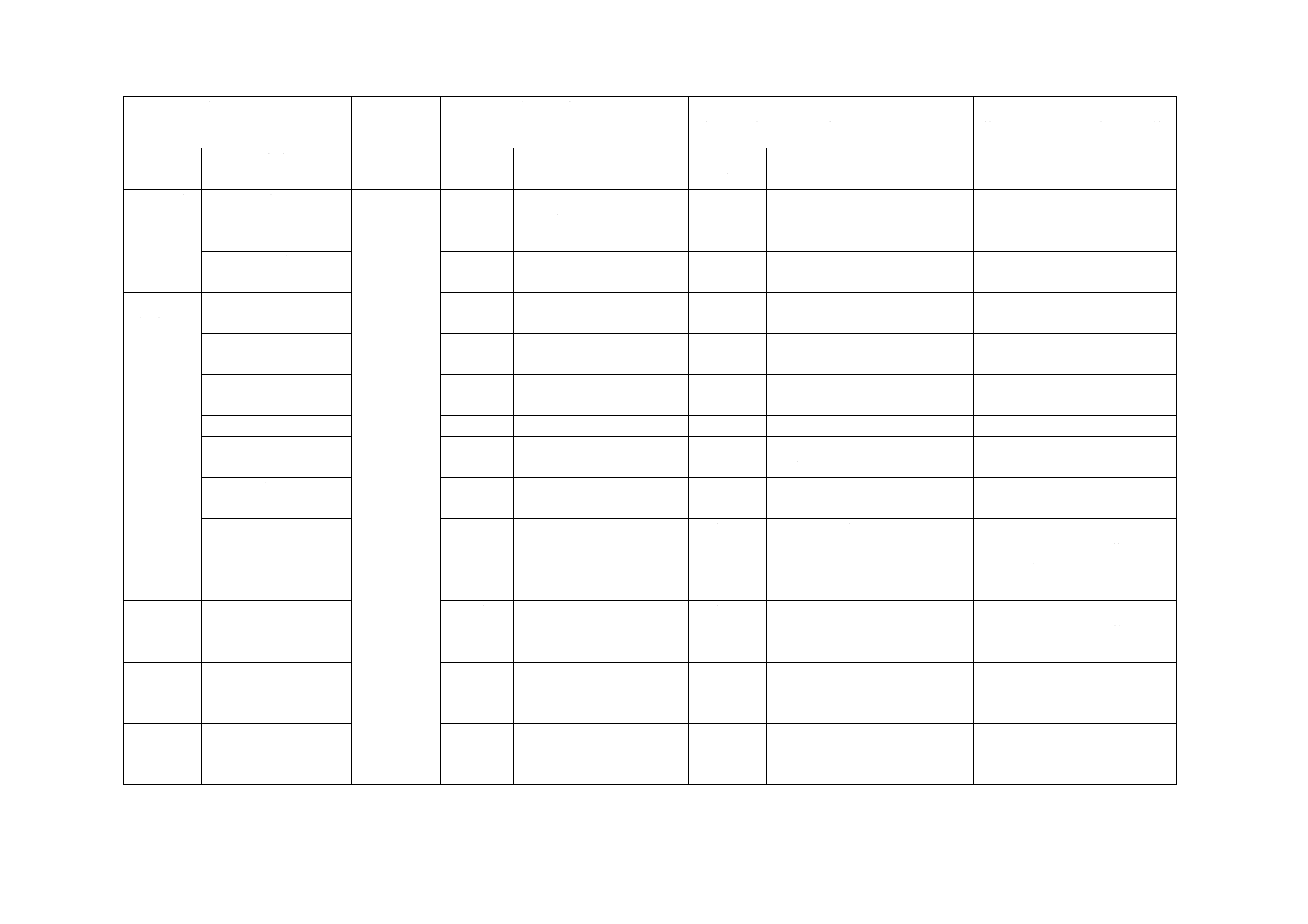
1 適用範
囲
単回使用の滅菌済
み真空採血管につ
いて規定。
1
単回使用の減圧及び非減
圧の静脈血検体採血管に
ついて規定。
変更
JISは,滅菌済み真空採血管だ
けを規定。
JISは,医療機器の第三者認証基
準として用いるため,滅菌済み真
空採血管だけの規格作成とした。
2 引用規
格
3 用語及
び定義
3.1 採血管
3.1
JISと同じ。
一致
−
−
3.2 真空採血管
3.2
JISと同じ。
一致
−
−
3.3 管
3.3
JISと同じ。
一致
−
−
3.4 栓
3.4
JISと同じ。
一致
−
−
3.5 一次包装
3.5
採血管の最小包装単位
変更
JISは,ISO規格より詳細に記
載。
実質的な差異はない。
3.6 内面
3.6
JISと同じ。
一致
−
−
3.7 添加物
3.7
JISと同じ。
一致
−
−
3.8 公称容量
3.8
JISと同じ。
一致
−
−
3.9 フリースぺー
ス
3.9
非減圧容器も含め規定。
変更
JISは,ISO規格の減圧容器だ
け規定。
JISは,滅菌済み真空採血管だけ
の規格作成を目的としている。実
質的な差異はない。
−
3.10
フルライン(非減圧容器
対象項目)
削除
JISは,ISO規格の減圧容器だ
け規定。
JISは,滅菌済み真空採血管だけ
の規格作成を目的としている。実
質的な差異はない。
3.10 吸引量
3.11
JISと同じ。
一致
−
−
3.11 使用期限
3.12
JISと同じ。
一致
−
−
2
T
3
2
3
3
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際規格番
号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対
策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
3 用語及
び定義(続
き)
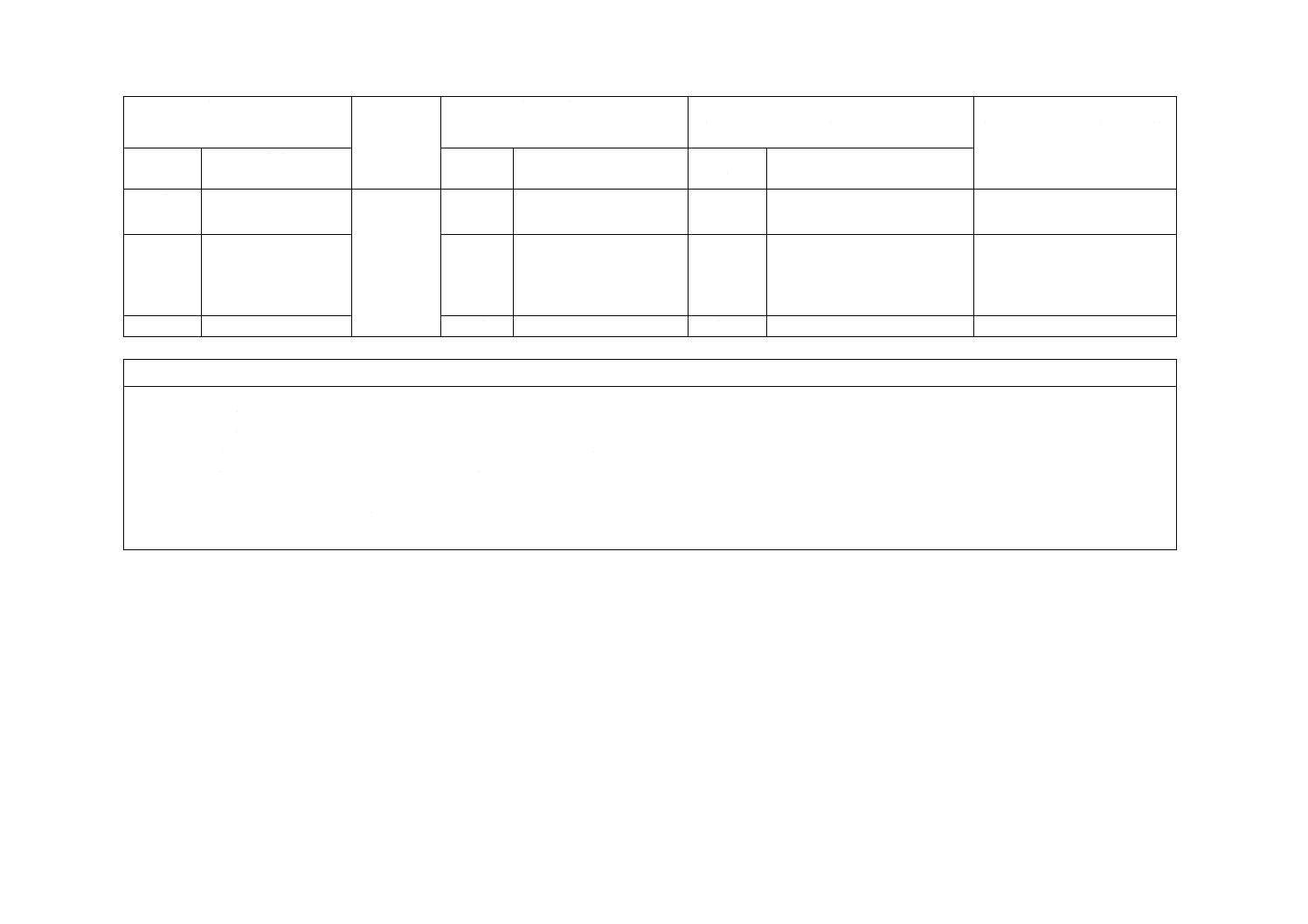
−
3.13
栓を閉めるトルク
削除
JISは,ISO規格の減圧容器だ
けを規定。
減圧容器の規定には不必
要。
3.12 目視検査
3.14
JISと同じ。
一致
−
−
4 構成及
び各部の
名称
例図及び名称を規
定。
−
−
追加
JISは,例図及び名称を記載す
る。
利用者の利便性を図る。実
質的な差異はない。
5 材料
材料の規定
4
JISとほぼ同じ。
変更
JISは,微生物除去の部分を削
除。
JISは,滅菌品だけの規定で
あり,箇条9(無菌性の保証)
と重複するため削除。実質
的な差異はない。
6 容量
6.1 給水量の規定
(試験は附属書A)
5.1
非減圧容器以外はJISと
ほぼ同じ。[試験は附属
書A及び附属書B]
変更
JISは,非減圧容器を削除し,
液体添加物以外の規格幅が広
い。
JISは,あらかじめ減圧され
た滅菌済み真空採血管だけ
の規格作成を目的としてい
る。添加物の規格幅は日本
の現状に合わせた。実質的
な差異はない。
6.2 最小フリース
ペースの規定(試験
は附属書A)
5.2
ISO規格は,フリースペ
ースを定量的に規定。
[試験は附属書A及び附
属書B]
変更
JISは,非減圧容器を削除し,
フリースペースを定性的に規
定。
JISは,あらかじめ減圧され
た製造販売業者が供給する
滅菌済み真空採血管だけの
規格作成を目的としてい
る。この規格で実質的な差
異はない。
7 設計
採血管の設計を規定
6
JISと同じ。
一致
−
−
8 構造
強度及び外観検査を
規定
7
JISと同じ。
一致
−
−
9 無菌性
の保証
滅菌保証レベル及び
滅菌バリデーション
の方法を規定。
8
滅菌バリデーションを規
定。
選択
JISは,滅菌保証レベル規定
及び滅菌バリデーション基準
追加。
JISは,日本独自の滅菌バリ
デーション基準追加に加え
て,SALを規定した。実質
的な差異はない。
2
T
3
2
3
3
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(I)JISの規定
(II)
国際規格番
号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
10 添加
物
10.1 添加物の公称
量を附属書Dで推
奨。
9.1
附属書Eの範囲であるこ
とを強制。
変更
JISは,添加物の規定を“推奨”
とした。
JISの内容で問題ない。ISO規
格の次回変更時に変更提案す
ることを検討。
10.2 採血管内の液
体添加物の測定
9.2
JISと同じ。
一致
−
−
11 表示
及びラベ
リング
11.1.1 ラベルの貼り
方
10.1
JISと同じ。
一致
−
−
11.1.2 ラベルの粘着
力
10.2
JISと同じ。
一致
−
−
11.1.3 管又はラベル
への表示事項
10.3
JISとほぼ同じ。
変更
JISは,表示を“推奨”とした。 JISの内容で問題ない。
11.1.4 カラーコード
11
JISとほぼ同じ。
変更
JISは,表示を“推奨”とした。 JISの内容で問題ない。
11.2 一次包装の表示
10.4
10.5
JISとほぼ同じ。
変更
JISは,薬事法の要求事項及び
呼称とした
JISの内容で問題ない。実質
的な差異はない。
11.3 記号の説明
−
−
追加
具体的に規定するため,JIS T
0307を追加。
実質的な差異はない。
−
11
採血管の識別方法を規定
削除
JISでは削除。
内容がJISの箇条11(表示及
びラベリング)と重複するた
め,削除。実質的な差異はな
い。
−
附属書A 非減圧管の公称容量・フ
リースペース。
削除
−
JISは,滅菌済み真空採血管
だけの規格作成を目的として
いる。実質的な差異はない。
附属書A
(規定)
減圧された容器の吸
引量試験及び最小フ
リースペース試験
附属書B JISと同じ。
一致
−
−
附属書B
(規定)
容器の漏れ試験
附属書C 非減圧及び減圧採血管に
ついて規定。
削除
JISは,非減圧採血管部分を削
除。
JISは,滅菌済み真空採血管
だけの規格作成を目的として
いる。実質的な差異はない。
2
T
3
2
3
3
:
2
0
11
(I)JISの規定
(II)
国際規格番
号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術
的差異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
附属書C
(規定)
容器の強度試験
附属書D JISと同じ。
一致
−
−
附属書D
(参考)
添加物の濃度及び液
体添加物の量
附属書E JISと同じ。
変更
JISは,参考としている。
一部の添加物だけで現実的で
はない。ISO規格の次回変更
時に変更提案することを検
討。
参考文献
附属書F
JISと同じ。
一致
−
−
JISと国際規格との対応の程度の全体評価:ISO 6710:1995,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 一致……………… 技術的差異がない。
− 削除……………… 国際規格の規定項目又は規定内容を削除している。
− 追加……………… 国際規格にない規定項目又は規定内容を追加している。
− 変更……………… 国際規格の規定内容を変更している。
− 選択……………… 国際規格の規定内容とは異なる規定内容を追加し,それらのいずれかを選択するとしている。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD…………… 国際規格を修正している。
2
T
3
2
3
3
:
2
0
11
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。






