T 3226-2:2015
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 2
4 要求事項························································································································· 4
4.1 材料 ···························································································································· 4
4.2 寸法 ···························································································································· 4
4.3 注射針の内くう(腔)を通過する流量の測定 ······································································· 4
4.4 針基と針管との接合 ······································································································· 4
4.5 針先 ···························································································································· 4
4.6 異常の有無(無ディファクト性)の確認············································································· 5
4.7 潤滑剤 ························································································································· 5
4.8 注射針の先端の測定点のひずみ ························································································ 5
4.9 NISとの機能的適合性 ····································································································· 5
4.10 組立・分解の容易性 ······································································································ 5
4.11 無菌性の保証 ··············································································································· 5
5 サンプリング ··················································································································· 5
6 注射針の前処理 ················································································································ 6
6.1 乾燥高温環境での前処理 ································································································· 6
6.2 低温保存環境での前処理 ································································································· 6
6.3 サイクル環境での前処理 ································································································· 6
7 標準環境及び試験装置 ······································································································· 6
7.1 一般 ···························································································································· 6
7.2 標準環境試験 ················································································································ 7
7.3 試験装置 ······················································································································ 7
8 注射針の先端の測定点のひずみの測定 ·················································································· 7
9 針基と針管との接合 ·········································································································· 8
10 包装 ····························································································································· 8
11 注射針及びNISの適合性検証試験方法 ················································································ 8
11.1 原理 ··························································································································· 8
11.2 装置 ··························································································································· 8
11.3 サンプル分量に係る要求事項 ·························································································· 9
11.4 手順 ··························································································································· 9
11.5 受容基準 ···················································································································· 10
11.6 試験報告書 ················································································································· 11
T 3226-2:2015 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
12 製造販売業者提供情報 ···································································································· 12
12.1 一般 ·························································································································· 12
12.2 表示 ·························································································································· 12
12.3 取扱説明書 ················································································································· 13
附属書A(規定)注射針を通過する流量の測定 ········································································· 14
参考文献 ···························································································································· 16
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 17
T 3226-2:2015
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,一般社団法人日本
医療機器テクノロジー協会(MTJAPAN)及び一般財団法人日本規格協会(JSA)から,工業標準原案を具
して日本工業規格を改正すべきとの申出があり,日本工業標準調査会の審議を経て,厚生労働大臣が改正
した日本工業規格である。
これによって,JIS T 3226-2:2011は改正され,この規格に置き換えられた。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。厚生労働大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
JIS T 3226の規格群には,次に示す部編成がある。
JIS T 3226-1 第1部:注射針を使用する注入システム−要求事項及びその試験方法
JIS T 3226-2 第2部:注射針−要求事項及びその試験方法
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
T 3226-2:2015
注射針を使用する医療用注入システム−
第2部:注射針−要求事項及びその試験方法
Needle-based injection systems for medical use-
Part 2: Needles-Requirements and test methods
序文
この規格は,2012年に第2版として発行されたISO 11608-2を基とし,我が国の実情に合わせるため,
技術的内容を変更して作成した日本工業規格である。
なお,この規格で点線の下線を施してある箇所は,対応国際規格を変更している事項である。変更の一
覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,再使用禁止で,両頭針の滅菌済み注射針であって,JIS T 3226-1の仕様に適合する注射針
を使用する医療用注入システムに用いる注射針(以下,注射針という。)の要求事項及びその試験方法につ
いて規定する。ただし,次に該当するものを除く。
− 歯科用注射針
− 薬剤充塡済み注射筒注射針
− 製造業者によって事前に組み立てられた注射針
− 組立不要,又は注入システムに取付け不要の注射針
注記1 平成30年9月30日までJIS T 3226-2:2011を適用することができる。
注記2 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 11608-2:2012,Needle-based injection systems for medical use−Requirements and test methods
−Part 2: Needles(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格のうちで,西暦年を付記してあるものは,記載の年の版を適用し,その後の改正版(追補を含む。)
は適用しない。西暦年の付記がない引用規格は,その最新版(追補を含む。)を適用する。
JIS C 60068-2-30:2011 環境試験方法−電気・電子−第2-30部:温湿度サイクル(12+12時間サイク
ル)試験方法(試験記号:Db)
注記 対応国際規格:IEC 60068-2-30:2005,Environmental testing−Part 2-30: Tests−Test Db: Damp
heat, cycle (12 h+12 h cycle)(IDT)
2
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JIS G 4305:2012 冷間圧延ステンレス鋼板及び鋼帯
JIS T 0307:2004 医療機器−医療機器のラベル,ラべリング及び供給される情報に用いる図記号
JIS T 3209:2011 滅菌済み注射針
注記 対応国際規格:ISO 7864:1993,Sterile hypodermic needles for single use(MOD)
JIS T 3226-1 注射針を使用する医療用注入システム−第1部:注射針を使用する注入システム−要求
事項及びその試験方法
注記 対応国際規格:ISO 11608-1,Needle-based injection systems for medical use−Requirements and
test methods−Part 1: Needle-based injection systems(MOD)
JIS Z 9015-1:2006 計数値検査に対する抜取検査手順−第1部:ロットごとの検査に対するAQL指標
型抜取検査方式
注記 対応国際規格:ISO 2859-1:1999,Sampling procedures for inspection by attributes−Part 1:
Sampling schemes indexed by acceptance quality limit (AQL) for lot-by-lot inspection(IDT)
ISO 9626:1991,Stainless steel needle tubing for the manufacture of medical devices及びAmendment 1: 2001
ISO 15510,Stainless steels−Chemical composition
3
用語及び定義
この規格で用いる主な用語及び定義は,次による。
3.1
注射針を使用する注入システム,NIS(needle-based injection system, NIS)
注射針及びマルチドーズ又はシングルドーズ容器を用いて医薬品を注入するための非経口投与用注入シ
ステム。
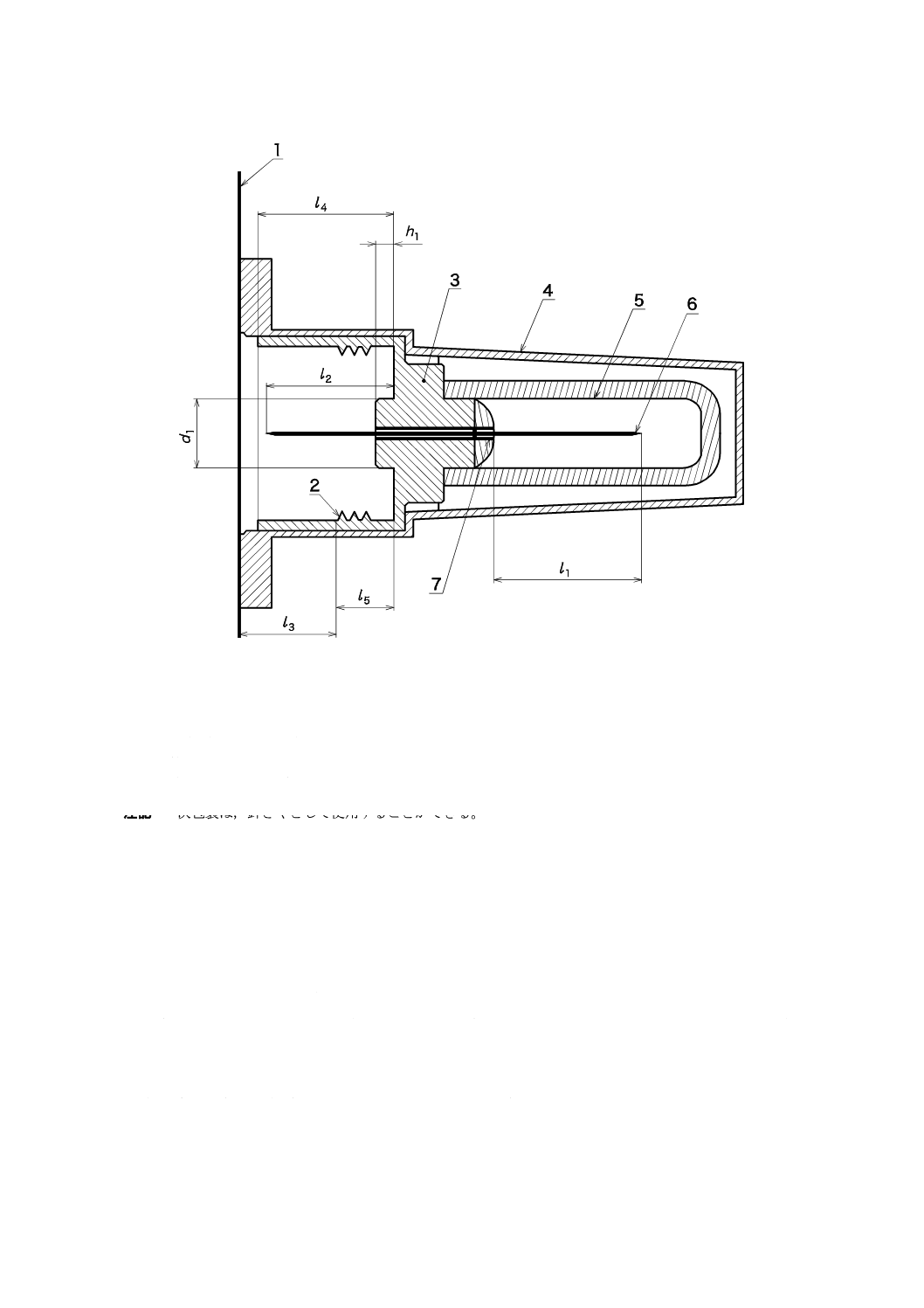
図1を参照。
3
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
シール
2
ねじ山
3
針基
4
一次包装
5
針さや(必須ではない)
6
針管
7
接着剤(使用する場合)
注記 一次包装は,針さやとして使用することができる。
図1−注射針の構成例
3.2
一次包装(unit packaging)
針管を直接に覆う包装で,注射針の無菌性を保持するためのもの。
3.3
使用者用の包装(user packaging)
同一の製造ロットからの1個又は複数個セットの注射針を,使用者に提供することを目的とした包装。
3.4
シール(seal)
一次包装内の注射針の無菌性を維持する取り外し可能な防壁。

4
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4
要求事項
4.1
材料
針管の材料は,JIS G 4305:2012で規定するSUS304,SUS304L若しくはSUS321,ISO 9626:1991の材料
又はISO 15510で規定したステンレス鋼とする。
4.2
寸法
4.2.1
一般
管の直径は,ISO 9626:1991の表1及びISO 9626:1991/Amd.1:2001の表2による。
注射針の被取付け部分の寸法(表1のl2,l3,l4及びl5)は,注射針が,JIS T 3226-1に適合した注射針
を使用する注入システムに取り付けて機能する寸法とする。
なお,注射針は,形状によってA形と非A形とに区分する。
4.2.2
A形1)の注射針
A形の注射針は,7.3に規定する試験装置のねじ山にかん(嵌)合し,A形の注射針と使用するように設
計及び表示されたシステムとを使用して機能しなければならない。
注射針の寸法は,表1による。
注1) この規格では“A形”を用いているが,“A型”としてもよい。
表1−注射針組立の寸法要求事項
単位 mm
長さ
寸法
l1
規定全長±1.25
l2
5.7 〜7.0
l3
<6.0
l4
<7.5
l5
<3.9
h1
0 〜1.0
d1
0 〜3.0
4.2.3
非A形2)の注射針
非A形の注射針は,特定の非A形の注射針を使用するように設計及び表示されたNISに適合し,機能
しなければならない。
注2) この規格では“A形”を用いているが,“A型”としてもよい。
4.3
注射針の内くう(腔)を通過する流量の測定
注射針は附属書Aに従って試験を行い,注射針を通過する液体の流量を毎分ミリリットル(mL/min)量
で測定しなければならない。
4.4
針基と針管との接合
箇条9によって試験したとき,針基と針管との接合が外れてはならない。
4.5
針先
×2.5の倍率に拡大して検査したとき,針先は鋭利で,先端が薄くなったり,凸凹になったり,引っかか
りがあってはならない。
カートリッジ側の針先は,カートリッジのセプタム(隔壁)に刺したとき,コアリング及び破片化が最
小限に抑えられるように設計する。

5
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4.6
異常の有無(無ディファクト性)の確認
針管は,JIS T 3209:2011の11.3に適合しなければならない。
4.7
潤滑剤
注射針の管を潤滑する場合は,裸眼又は矯正視力で,潤滑剤が針管の外面に液滴として見えてはならな
い。
4.8
注射針の先端の測定点のひずみ
箇条8によって試験したとき,先端のカニューレ点のひずみは,表2による。
表2−注射針の先端での最大許容ひずみ
単位 mm
注射針の先端の長さ
l1
最大許容ひずみ
dmax
8
0.9
12
1.1
16
1.4
その他
0.07×l1+0.3
4.9
NISとの機能的適合性
NISとの適合性は,箇条11によって検証する。
4.10 組立・分解の容易性
開封した一次包装から注射針を取り外すことなく,注射針の取り付けができなければならない。
適合性は,箇条11によって確認する。
4.11 無菌性の保証
無菌性の保証は,滅菌バリデーション基準又はこれと同等以上の基準に基づき,無菌性の担保を行う。
注記 滅菌バリデーション基準には,厚生労働省が定めた滅菌バリデーション基準がある。
5
サンプリング
350本の注射針を選択する。最初のサンプル検査には,50本の注射針を使用する(サンプル1)。2本以
上の注射針が試験基準を満たさない場合,検査した注射針のロットは不合格とする。しかし,注射針のロ
ットは,最初のサンプル(の試験適合)だけでは合格とはならない。
注射針のロットが最初のサンプル検査で合格となった場合,更に別の50本の注射針サンプルで2回目の
検査を行う(サンプル2)。最初の検査から合計して3本以上不合格となった場合は,そのロットは不合格
とする。検査で不合格とされる注射針がなかった場合,その注射針のロットは合格とする。
1本又は2本の注射針が検査で不適合となった場合には,更に別の注射針サンプル50本を3回目の検査
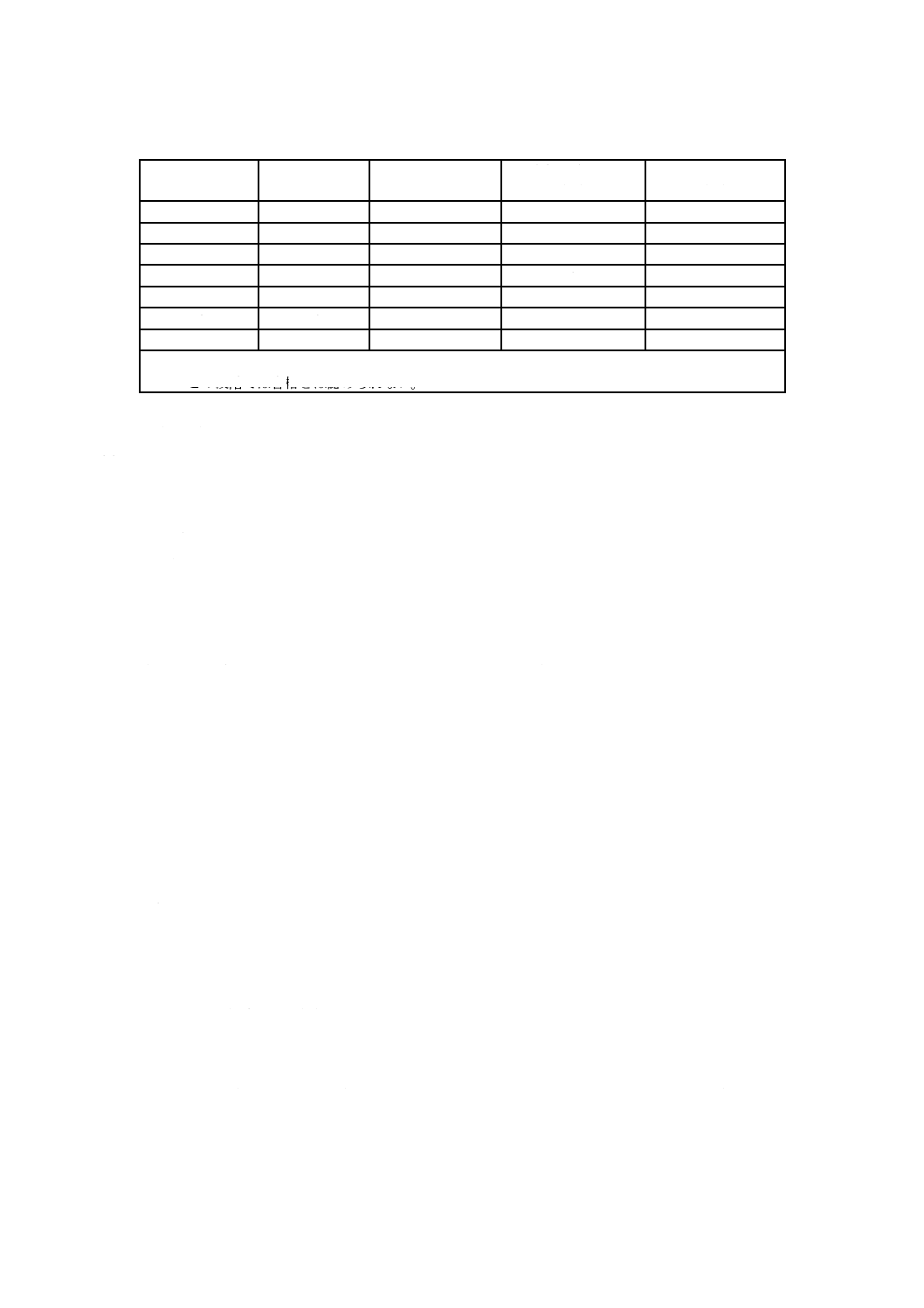
に選択する。検査は,表3に示す検査の合否判定基準に従いながら,表の順序で行う。
6
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表3−サンプリング計画及び合否判定基準a)
サンプル番号
サンプル数
累計サンプル数
合格判定基準
(本)
不合格判定基準
(本)
1
50
50
該当せずb)
2
2
50
100
0
3
3
50
150
0
3
4
50
200
1
4
5
50
250
2
4
6
50
300
3
5
7
50
350
4
5
注a) 表の数字は,JIS Z 9015-1:2006に基づいている。
b) この段階では合格とは認められない。
6
注射針の前処理
6.1
乾燥高温環境での前処理
一次包装内の注射針を,次の高温環境の試験チャンバ内に96時間以上置く。
− 温度:70±2 ℃
− 相対湿度:50±10 %RH
6.2
低温保存環境での前処理
一次包装内の注射針を,次の低温環境の試験チャンバ内に96時間以上置く。
− 温度:−40±3 ℃
6.3
サイクル環境での前処理
一次包装内の注射針を,試験チャンバ内に入れる。環境の調整は,JIS C 60068-2-30:2011に規定する次
の条件によって実施する。
− 方法1[JIS C 60068-2-30:2011の図2 a)参照]
− 下限温度:25±3 ℃(湿度の要求なし)
− 上限温度:55±2 ℃
− 6サイクル
注記 JIS C 60068-2-30:2011の箇条4,箇条7及び箇条9を参照。
7
標準環境及び試験装置
7.1
一般
試験には,要求される正確性(キャリブレーション)及び精度(ゲージR&R)をもつ適切な試験システ
ムを用いる。試験装置のゲージR&R(反復性及び再現性によって評価する)は,対象とする測定における
許容範囲の20 %以下,破壊試験の測定においては,許容範囲の30 %以下でなければならない。ゲージR&R
は,±2 SD以上を包含する(ばらつきの約95 %以上を包含する)ものでなければならない。
例 測定仕様限界が±0.01 mL(0.02 mLの範囲)の測定システムに求められるゲージR&Rは,許容
範囲に対するゲージR&Rの比が20 %となるものであり,この例では,ゲージR&R(4u,u:標
準不確かさ)は0.02 mL/5(=0.004 mL)となる。また,測定の不確かさは±2 SD(ISO/IEC Guide
98-1参照)であり,この例では0.002 mLとなる。
投与量Vは,質量法によってm(gで表示)で記録し,試験条件下での試験溶液の密度(ρ)(g/mLで表
7
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
示)を用いて容積(Vmeas)に変換する。次の式によって質量法による測定値から容積法による値に変換す
る。
ρ
meas
m
V
=
7.2
標準環境試験
特に規定がない場合は,次の環境下で4時間以上保存した後,実施する。
− 温度:18 ℃〜28 ℃
− 相対湿度:25 %RH〜75 %RH
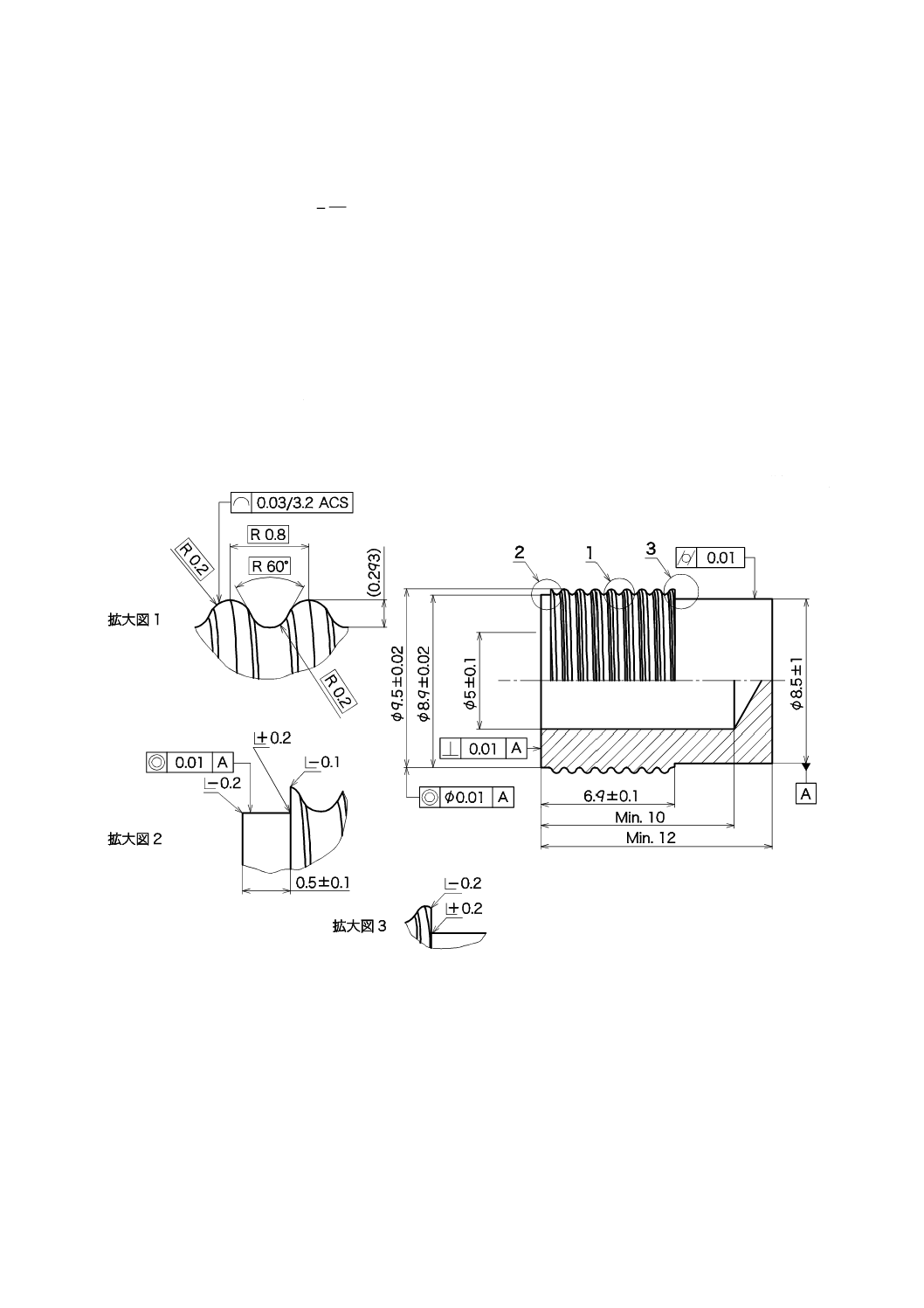
7.3
試験装置
試験装置は硬化鋼などから製造されるもので,ジグに取り付けて使用する。
寸法は図2による。
単位 mm
図2−試験装置
8
注射針の先端の測定点のひずみの測定
箇条5によって,サンプルを選択する。注射針を試験装置(図2参照)に,0.07±0.01 N・mのトルクで
取り付ける。光学コンパレータの横送り台に取り付けられたVブロックの上に試験装置を置く。試験装置
外径の円筒部分の上端を,コンパレータのX軸にそろえる。
“Vブロック”を試験装置の外径の半分だけ上に移動し,試験装置の中心線をコンパレータのX軸に合
わす。

8
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
試験装置を手で回して,図3に示す測定点の高さで,コンパレータのX軸に対する内くう(腔)の中心
の最大ひずみ(正又は負)を記録する。
1
測定点
図3−ひずみを測定するときの注射針上の位置
9
針基と針管との接合
箇条5によってサンプルを選択する。
A形注射針の場合は7.3の試験装置(図2参照)に,非A形注射針の場合はNISに,いずれの場合につ
いても取扱説明書に従って,注射針を,0.07±0.01 N・mのトルクで取り付ける。
JIS T 3209:2011に従って,注射針の先端に力を加えて,針管を引く。試験装置又はNISの軸の方向に,
5秒間引く。
6.1〜6.3によって,注射針を前処理した後,新しい注射針で試験を繰り返す。
10 包装
注射針は,一次包装に密封し,一つ以上の一次包装を使用者用の包装に入れる。一次包装の材料は,注
射針に悪影響を与えてはならない。一次包装の材料及び設計は,次による。
a) 通常の取扱い及び保管の下で,注射針の滅菌性を維持する。
b) 容器から取り出すときに,注射針が汚染されるリスクを最小限に抑える。
c) シールを取り外した後,注射針とNIS又はカートリッジとの組立てに障害があってはならない。
d) 通常の取扱い,輸送及び保管の間,注射針を適切に保護する。
e) 一度開封した場合,包装の再密封が不可能で,包装を開封したことが明確に分かるものとする。
11 注射針及びNISの適合性検証試験方法
11.1 原理
NISに注射針を取り付けるために,規定のトルクを適用する。少なくとも10秒間静止させた後,臨床的
に関与する流体経路は投与量試験(NISのVhigh及びVlowの設定時,VlowがNISの最大投与量10 %以下で
VhighがNISの最大投与量90 %以上である。)を通じて異常のないことを確認する。
最後に,針基を取り外したときのトルクを測定し,記録する。
11.2 装置
11.2.1 トルク試験機
(注射針及びねじ山で)注射針及びNISをしっかりと保持することが可能な装置。この装置は,±0.001
N・mの分解能をもち,0.07±0.01 N・mの取り付け時のトルク(時計回り)を加えることが可能である。ま
た,この装置は,取り外し時のトルク(反時計回りで)でピーク値の結果の読み取りもできるものである。
注射針がねじ山をもたない場合,取り付け時及び取り外しトルク試験は,相応する要求事項をあてはめる。
9
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11.2.2 タイマ
最小目盛が1秒で10秒間測定できるものとする。
11.2.3 精度の高い投与装置
0.000 1 gの分解能で,試験で用いられるNISから排出される流体の質量を把握し,量ることができる装
置。これは計量容器及び重量皿の付いた実験用はかり(秤)を含む(JIS T 3226-1参照)。
11.3 サンプル分量に係る要求事項
11.3.1
試験用注射針サンプルは,11.3.2〜11.3.5に規定する要求事項を考慮して選択する。
11.3.2
投与量精度は,事前に決められた2点の投与量のランダムな順序での組合せで排出を測定するこ
とによって評価する。
11.3.3
2点の投与量は,Vlow(NIS最大投与量の10 %以下),及びVhigh(NIS最大投与量の90 %以上)を
含む。
11.3.4
投与量が可変のNISに対し,高投与量及び低投与量各々で新しい注射針を使用し,各々の投与量
で60回(n=60)の測定を行うことが要求される。それゆえ,この試験方法は,試験を行ったNISについ
て投与量結果を得るために,合計n=120の注射針を必要とする。投与量が固定のNISについては,各NIS
の試験のために,その投与量レベルで,新しい注射針を使用し,合計n=60が必要とされる。
なお,単回使用のNISについては,可変投与型のNISと同様のやり方で実施する。
11.3.5
投与量精度試験のために使用されるn=120の注射針を,針基を取り外しトルク試験のために使用
しなければならない。
実際の製剤又は製剤と同様の結果を生む液体を,試験のために使用することができる。
11.4 手順
11.4.1
針基の取り付け
注記 この細分箇条は,取り外し時のトルク試験に対する前提条件である。
11.4.1.1
試験する120本の注射針及びNISの適切な数量を選択する。注射針の数は,試験前に計算する。
NISの液量及び最大のNIS投与量は,必要な量を決定する要素の一部である。
受容基準及び試験結果によって,追加の注射針及びNISを必要に応じて準備し,さらに,試験する必要
がある場合もある。
11.4.1.2
再使用可能なNISに,必要に応じて関連するカートリッジを装備する。カートリッジ非交換式
のNISについては,液体はNIS本体の中にあるため,カートリッジは使用しない。
11.4.1.3
液体の流れが排出されるまで,必要に応じて,予備の注射針を取り付け,NISを空打ちする。こ
れは,NISの駆動部品がピストンラバーに確実に触れるようにする,すなわち,NISが空打ちされるよう
にするためである。予備の注射針を取り外す。
11.4.1.4
注射針のトルク試験装置にNISを挿入する。
11.4.1.5
0.07±0.01 N・mのトルクを加え,NISに注射針を取り付ける。最大トルク(取り付け時のトルク)
の測定結果を記録する。
11.4.1.6
10秒タイマーを開始する。取り付けて少なくとも10秒間そのままにする。慎重に試験装置から
NISを取り除く。
11.4.2
注射針の投与量精度
11.4.2.1
投与量精度は,空打ちをした注射針又はしていない注射針,また,箇条7で指定されたゲージ
R&Rの基準を満たした測定機器で測定することができる。
11.4.2.2
はかり(秤)及び測定機器を準備する。
10
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11.4.2.3
(まだ空打ちをしていない場合)製造販売業者の取扱説明書に従ってNISを空打ちする。
11.4.2.4
NISの初回の目標用量を選択し,設定する。これは,ランダム又は交互投与順序によるVlow又は
Vhigh用量のいずれかである。
11.4.2.5
はかり(秤)を補正する。
11.4.2.6
NISの注入ボタンに圧力を加え,かつ,維持し,測定機器に液体を排出する。
11.4.2.7
製造販売業者の取扱説明書に従って用量を排出する。
11.4.2.8
はかり(秤)/測定機器に示される質量を安定させる。取扱説明書に記載された持続時間が経
過した後,5秒以内に最初に安定した質量を観察し記録する。
各投与量排出の直前に質量を量っておく。
新しい受皿が必要な場合,少量の液体を追加してはかり(秤)の上に置き重量を補正する。
11.4.3
注射針を回して取り外すトルク
11.4.3.1
トルク試験装置のNISを慎重に交換し,7.3に規定する試験装置から針基を緩め取り外し,最大
トルク(取り外し時のトルク)の測定結果を記録する。
11.4.3.2
新しい注射針を取り付け,NISで第二の目標用量を設定し,上記の手順(11.4.1.5から11.4.3.1
まで)を繰り返す。これは,ランダム又は交互投与順序に従った(Vlow又はVhighのいずれか)他の用量で
ある。
11.4.3.3
同じNISとカートリッジ,又はカートリッジ非交換式のNISを用いて,上記の手順(11.4.1.5か
ら11.4.3.2まで)を繰り返す。
11.4.4
交換式NISで試験を繰り返す
11.4.4.1
液体が標準的なシステムNISの使用方法によってなくなるまで,すなわち,次の最大投与量が,
設定及び/又は排出することができなくなるまで,カートリッジ非交換式のNIS,又はカートリッジ交換
式のNISを使用する。
11.4.4.2
新しいものが必要なときには,新しいカートリッジ非交換式のNIS,又は新しいカートリッジ(も
し取れなくなっていた場合は,新しいカートリッジホルダー)を新しいカートリッジ交換式のNISととも
に使用する。
11.4.4.3
120本全ての(投与量が固定のNISの場合は,60本)注射針の試験が終わるまで11.4.1.5から
11.4.3.2までの手順を繰り返す。
必要な全てのカートリッジ交換式のNIS(又はカートリッジ非交換式のNIS),及び試験される全ての注
射針のサンプルに関わる試験計画(高及び低の設定をランダム又は交互に)に従う。試験液の適切な密度
及び試験環境条件を用いて,全ての質量の測定値を体積に変換する。
11.5 受容基準
11.5.1
注射針取り付け時のトルク値は,全て0.060〜0.080 N・mの範囲でなければならない。
11.5.2
投与量≦0.20 mLの場合,計算値(収集された液体の容量)が設定用量の±0.01 mL以内であれば
許容できると判断する。
サンプルの大きさに対する両側許容限界係数k(すなわち,n=60,k=2.67,95 %の信頼水準及び97.5 %
の内在確率)を使用して,次の二つの条件が満たされなければならない。
11
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
UL
S
k
s
≦
)
(
sd
×
+
及び
LL
S
k
s
≧
)
(
sd
×
−
ここに,
s: 標本平均
Ssd: 標本標準偏差
UL: 上限規格限界
LL: 下限規格限界
注記 ISO 16269-6:2005の附属書Eは,真の母集団平均及び標準偏差が未知の場合,両側統計
的許容区間を構成する許容限界係数を示している。JIS T 3226-1の表B.2(両側許容限界
因子)は,95 %信頼水準の両側許容限界を包括的に示している。
11.5.3
投与量>0.20 mLの場合,計算値(収集された液体の容量)が設定用量の±5 %以内であれば許容
できると判断する。
サンプルの大きさに対応する両側許容限界係数k(例えば,n=60,k=2.67,95 %の信頼水準及び97.5 %
の内在確率)を使用して,次の二つの条件が満たされなければならない。
UL
S
k
s
≦
)
(
sd
×
+
及び
LL
S
k
s
≧
)
(
sd
×
−
ここに,
s: 標本平均
Ssd: 標本標準偏差
UL: 上限規格限界
LL: 下限規格限界
注記 ISO 16269-6:2005の附属書Eは,真の母集団平均及び標準偏差が未知の場合,両側統計
的許容区間を構成する許容限界係数を示している。JIS T 3226-1の表B.2(両側許容限界
因子)は,95 %信頼水準の両側許容限界を包括的に示している。
11.5.4
注射針の取り外し時のトルク値は,0.100 N・m未満でなければならない。注射針がねじ山をもた
ない場合,該当する取り付け時及び取り外し時のトルク試験は,相応の要求事項を満たさなければならな
い。
11.5.4.1
3本以上の注射針の結果が0.100 N・m以上のピーク(取り外し)トルク値の場合,試験は拒否さ
れる。
11.5.4.2
0.100 N・m以上のピーク(取り外し)トルクがゼロ,1本,又は2本の注射針の結果の場合,試
験結果は合格である。
11.6 試験報告書
試験報告書には,少なくとも次を含めなければならない。
a) 試験日
b) 試験に用いたNISの識別
c) 試験に用いた注射針の識別
12
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
d) 試験に用いた装置/機器
e) 試験に用いた試験流体/試験液/試験薬の同定
f)
試験環境の温度及び相対湿度
g) 注射針の針基取り外し時のトルク及び投与量精度データを含む試験の測定結果
12 製造販売業者提供情報
12.1 一般
注射針には,潜在的な使用者の訓練及び知識を考慮して,安全に使用するために十分な情報及び製造販
売業者を識別するための情報を添えなければならない。
取扱説明書は,取扱説明書がなくても注射針が安全に使用できる場合を除いて,二次包装ごとに添付し
なければならない。
4.3に従って決定した流量は,ラベルに表示することが望ましい。
12.2 表示
12.2.1
一般
注射針を安全に使用するために不可欠な,一次包装又は使用者用の包装上の表示は,明瞭で,読みやす
いものでなければならない。
12.2.2
一次包装上の表示
一次包装上の表示には,少なくとも次を含めなければならない。
a) 製造販売業者の名称又は商標
注記1 商標又はロゴは,製造販売業者を識別するために十分である。
b) 針管の外径及び長さ(mm)
注記2 o.d.×L
ここに,
o.d.: 針管の公称外径(mm)
L: 針管の公称長さ(mm)
(例 0.33 mm×12.7 mm)
c) “滅菌済み”の旨
d) 製造番号又は製造記号
e) 必要ならば,その使用期限(例えば,年月を,YYYY-MMで表示する。例 2014-12)。
一次包装に使用期限を表示できない場合には,二次包装に表示する。
12.2.3
使用者用の包装の表示
使用者用の包装の表示には,少なくとも次を含めなければならない。
a) 製造販売業者の氏名又は名称,及び住所
b) 使用者が注射針を識別するために必要とする次の事項
1) 12.2.2 b)に従った表示
2) 販売名
3) A形注射針の場合は,“A形”の表示。非A形注射針の場合は,“(非A形注射針との使用を意図し
たNISの販売名)専用”の表示。
4) A形注射針の要求事項を満たす注射針で,かつ,非A形注射針用のNISに取り付けて機能するよう
に設計された注射針の場合,“A形”(また,注射針が別のNISに使用できる旨)の表示。

13
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
c) 注射針との使用を意図したNISの情報(非A形注射針の場合,特定のNISをリストアップする。)
d) “再使用禁止”の旨(“ディスポーザブル”の表現は使用しない。)
e) “滅菌済み”,“STERILE”など滅菌済みの旨
f)
製造番号又は製造記号
g) 使用期限(例えば,年月を,YYYY-MMで表示する。例 2014-12)
h) 特別な保存及び/又は取扱条件(該当する場合)
i)
入り数
j)
その他法定表示事項
12.2.4
図記号の使用
12.2.2及び12.2.3は,JIS T 0307:2004に規定する適切な図記号を使用することによってこれに替えても
よい。
注記 JIS T 0307:2004に規定する主な図記号の例を,表4に示す。
表4−JIS T 0307に規定する図記号の例
12.3 取扱説明書
添付する場合,取扱説明書には少なくとも次を含めなければならない。
a) 製造番号又は製造記号,及び使用期限に関する情報が省略できることを除いて,12.2.3で要求する情
報
b) 注射針の使用が想定される全てのNIS(A形注射針との使用を意図したNIS,又は非A形注射針との
使用を意図したNIS)及びカートリッジについての詳細
c) 注射針の固定方法が,NISの取扱説明書に示された手順と異なる場合,NISへの注射針の固定方法に
ついての情報
d) 廃棄方法についての情報
14
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
注射針を通過する流量の測定
A.1 原理
サンプルの注射針を通して水流が適切に測定された流量計,又は目盛こう(較)正を組み合わせた図A.1
の装置を用いて求める。
A.2 試薬
A.2.1 蒸留水
A.3 装置
A.3.1 試験装置にはサンプルの注射針を接続する。
A.3.2 水槽は試験装置に接続し,圧縮空気を用いて110 000±1 000パスカル(Pa){1.1±0.01バール}に
加圧する。
A.4 試験手順
23±2 ℃の蒸留水を水槽にはり,水槽に接続されている試験装置に試験の注射針を装着するか又はひね
(捻)って留める。蒸留水は,少なくとも15±0.25秒間,針を通って流れ,流出した水は適切な容器に収
集する。
体積は,蒸留水の密度が1.000 g/mLに等しいと仮定して,質量を量ることによって測定する。
注記 温度,圧力及び保存時間の許容範囲は,一般的に達成されているものを考慮して選択したが,
全体の公差とは異なっていることが認識されている。一つの試験の実行に際しては,三つのバ
ッチから20本のサンプル注射針を割り当てる。
A.5 試験解析
注射針を通して予想最小流量を計算する(mL/分)。一つの試験実行の決定のための算術平均及び標準偏
差を計算し,統計的公差間隔を定義する。
注射針を通して蒸留水の流量を計算するために,片側統計的許容間隔を表現するために信頼レベル0.95
(95 %)及び確率レベル0.95(95 %)を使用する。
流路内の蒸留水の温度は,25 ℃以上になってはならない。
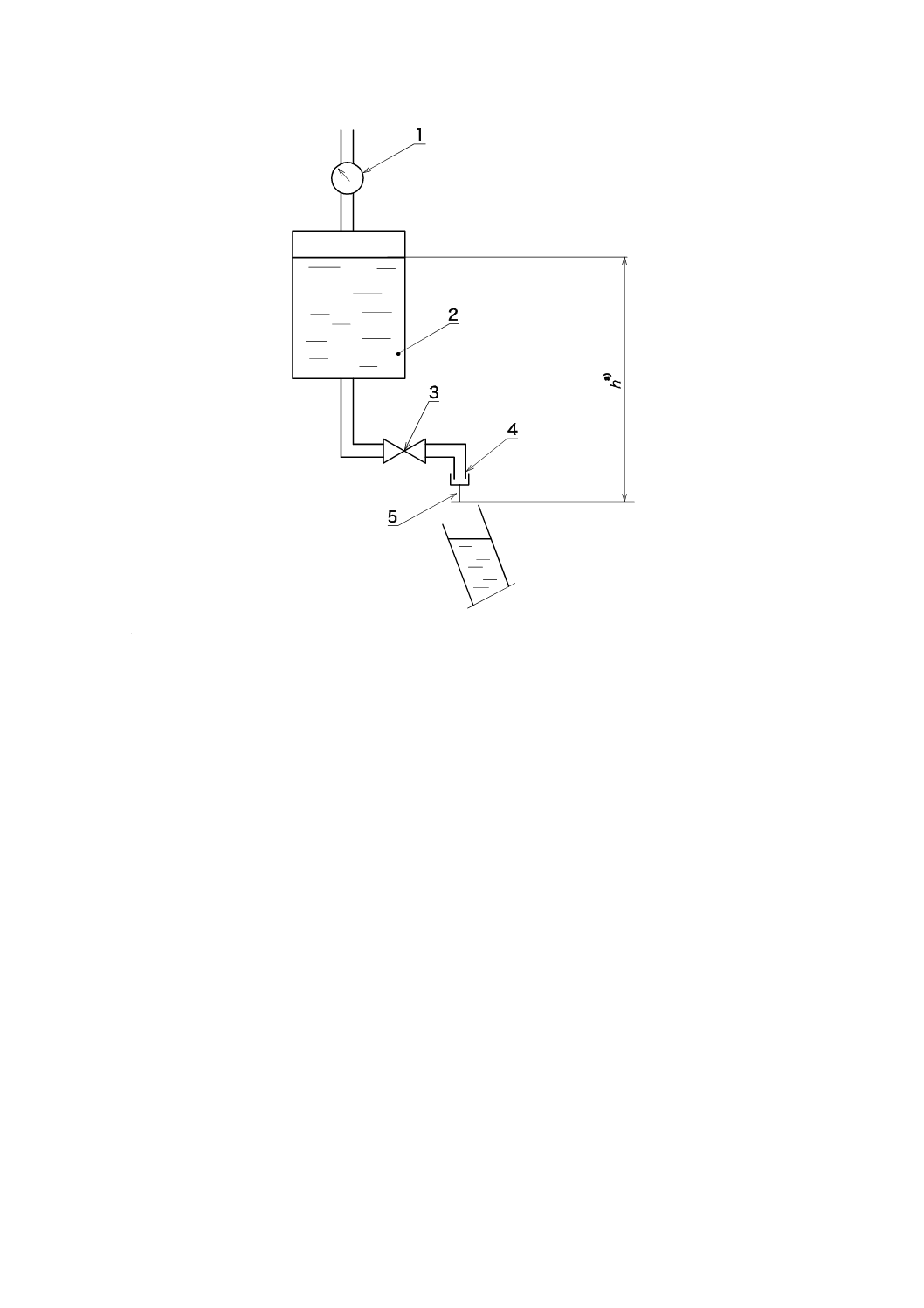
15
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1
圧力計
2
蒸留水
3
開閉バルブ
4
注射針接続部
5
針管
注a) 最大100 mm
図A.1−試験装置の例
16
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考文献
[1] JIS Q 9000 品質マネジメントシステム−基本及び用語
注記 対応国際規格:ISO 9000,Quality management systems−Fundamentals and vocabulary(IDT)
[2] ISO/IEC Guide 98-1,Uncertainty of measurement−Part 1: Introduction to the expression of uncertainty in
measurement
[3] ISO 7000,Graphical symbols for use on equipment−Index and synopsis
[4] ISO 10993-1,Biological evaluation of medical devices−Part 1: Evaluation and testing within a risk
management process
[5] ISO 11608-3,Needle-based injection systems for medical use−Requirements and test methods−Part 3:
Finished containers
[6] ISO 16269-6:2005,Statistical interpretation of date−Part 6: Determination of statistical tolerance intervals
[7] EN 10088-1,Stainless steels−Part 1: List of stainless steels
17
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書JA
(参考)
JISと対応国際規格との対比表
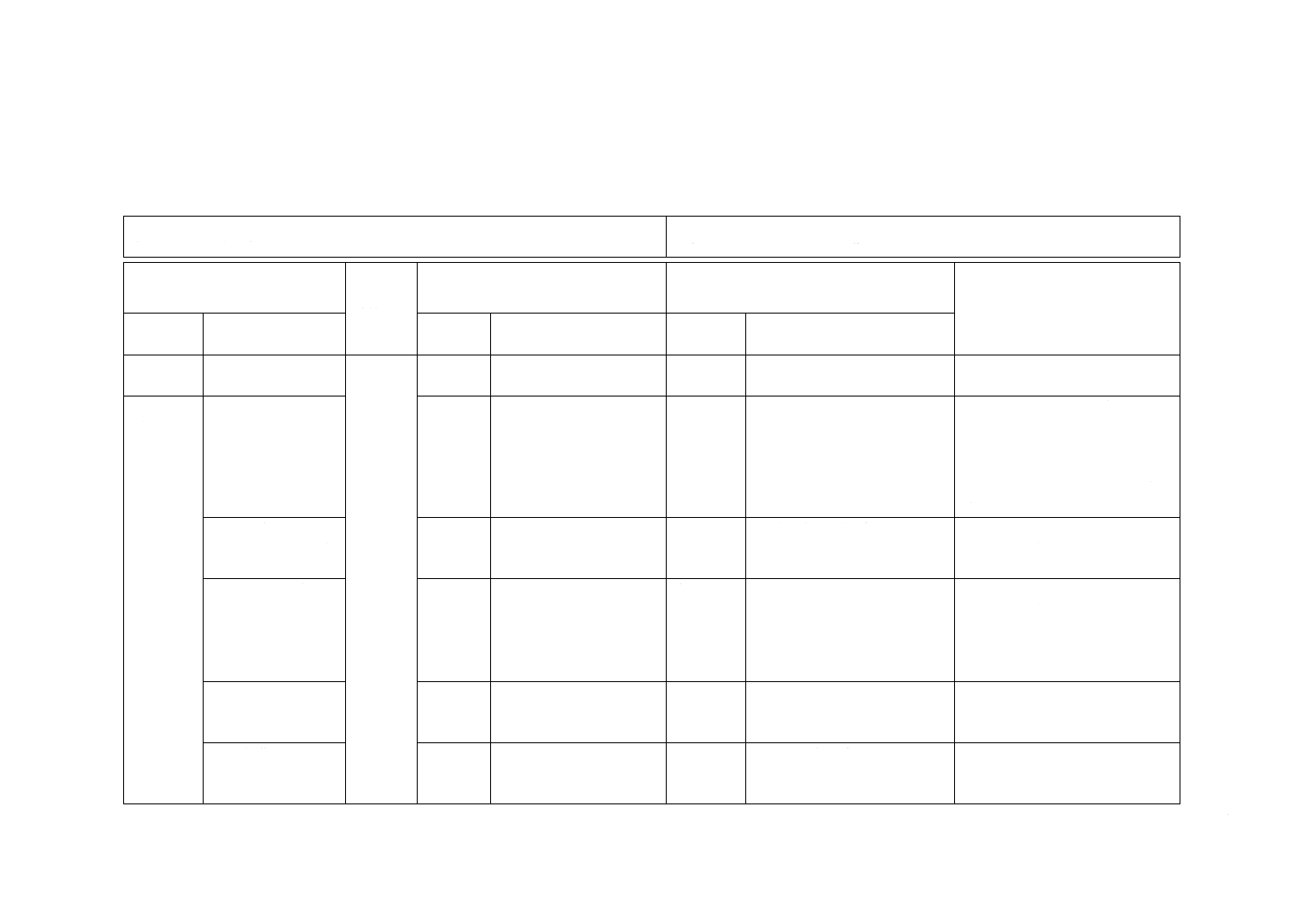
JIS T 3226-2:2015 注射針を使用する医療用注入システム−第2部:注射針−要求
事項及びその試験方法
ISO 11608-2:2012,Needle-based injection systems for medical use−Requirements
and test methods−Part 2: Needles
(I)JISの規定
(II)
国際規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
2 引用規
格
4 要求事
項
4.1 材料を規定
4.1
JISとほぼ同じ
追加
JIS G 4305:2012に規定する
SUS304,SUS304L,SUS321を
追加した。
この規格で規定する注射針は,滅
菌済み注射針であることから,
JIS T 3209:2011の規定を追加し,
他のJISとの整合を図った。追加
したSUSはISO 15510と対応す
る。
4.2.1 一般
4.2.3 非A形の注射
針
4.2.1
−
JISとほぼ同じ
−
変更
追加
A形,非A形の表記をJISで
は残した。
国内での使用において,A形,非
A形表記の存続の要望があり,今
回は残した。
4.2.2 A形の注射針
4.2.2
JISとほぼ同じ
変更
A形,非A形の表記をJISで
は残した。
表1のl5を3.9に修正した。
国内での使用において,A形,非
A形表記の存続の要望があり,今
回は残した。
国内既販売品の規格に整合させ
た。
4.3 注射針の内くう
(腔)を通過する流
量の測定
4.3
JISとほぼ同じ
削除
注記部分の表示を削除した。
技術的な差異はなし。
4.11 無菌性の保証
4.11
JISとほぼ同じ
追加
通知の規定を追記した。
バリデーション基準は,ISO
11134,ISO 11135及びISO 11137
を翻訳したもの。
2
T
3
2
2
6
-2
:
2
0
1
5
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
18
T 3226-2:2015
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
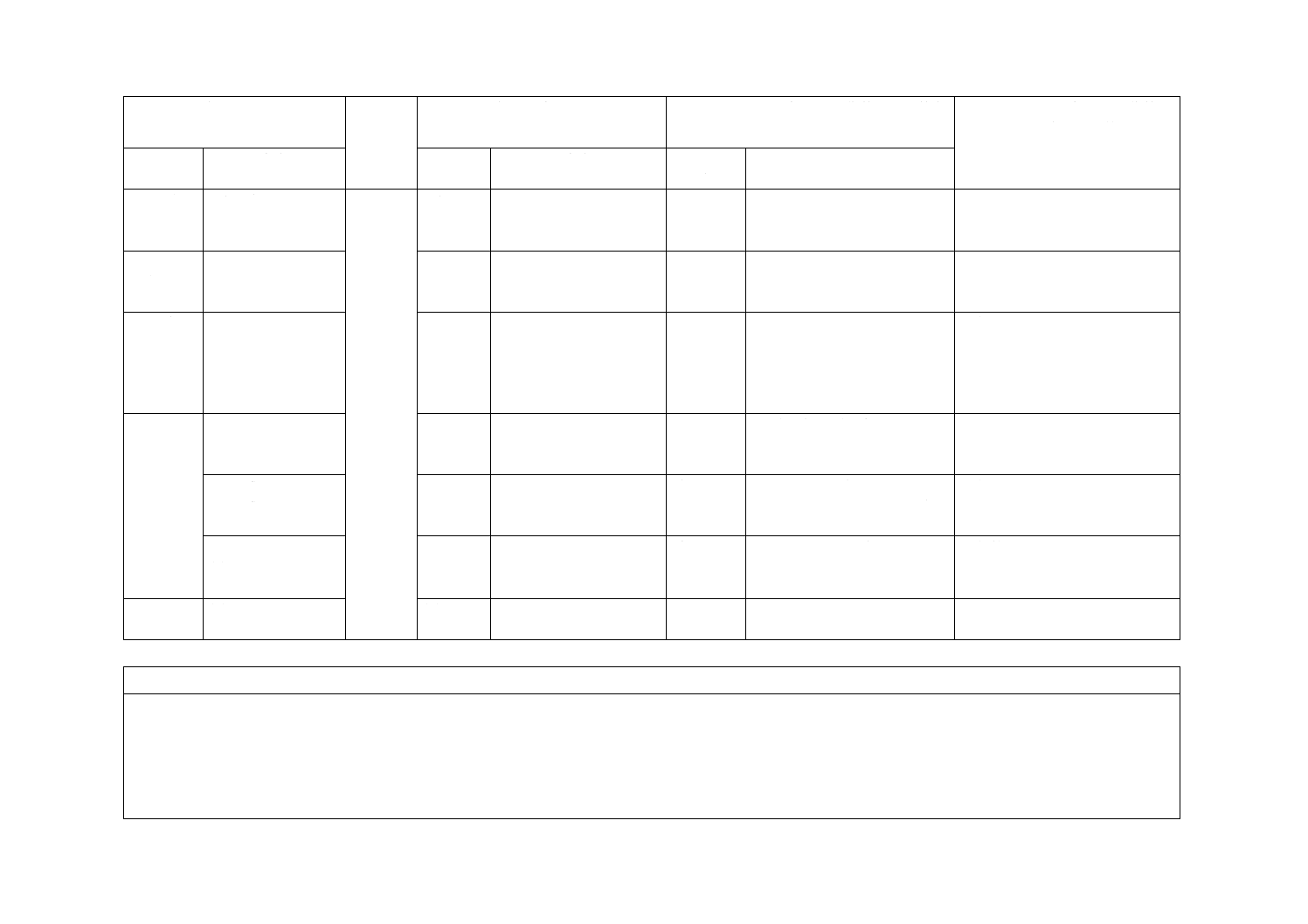
(I)JISの規定
(II)
国際規格
番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条
ごとの評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
7 標準環
境及び試
験装置
7.1 一般
7.1
−
削除
片側しか限度がない要求事項
を削除した。
技術的な差異はなし。
9 針基と
針管との
接合
−
9
JISとほぼ同じ
変更
A形,非A形の表記をJISで
は残した。
国内での使用において,A形,非
A形表記の存続の要望があり,今
回は残した。
11 注射針
及びNIS
の適合性
検証試験
方法
11.5.2
11.5.3
11.5.2
11.5.3
−
追加
注記に許容限界係数k値の説
明を追記した。
技術的な差異はなし。
12 製造販
売業者提
供情報
12.2.3 b) 3)
12.2.3 b) 4)
−
−
追加
A形,非A形の表記をJISで
は残した。
国内での使用において,A形,非
A形表記の存続の要望があり,今
回は残した。
12.2.3 i)
12.2.3 j)
−
−
追加
“入り数”の追加
“その他法定表示事項”を追加
した。
技術的な差異はなし。
12.2.4 図記号の使
用
−
−
追加
JIS T 0307に規定する主な図
記号を追記した。
技術的な差異はなし。
附属書A
(規定)
図A.1
図A.1
JISとほぼ同じ
変更
“針管”の説明を追加した。
技術的な差異はなし。
JISと国際規格との対応の程度の全体評価:ISO 11608-2:2012,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 削除……………… 国際規格の規定項目又は規定内容を削除している。
− 追加……………… 国際規格にない規定項目又は規定内容を追加している。
− 変更……………… 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD…………… 国際規格を修正している。
2
T
3
2
2
6
-2
:
2
0
1
5
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。









