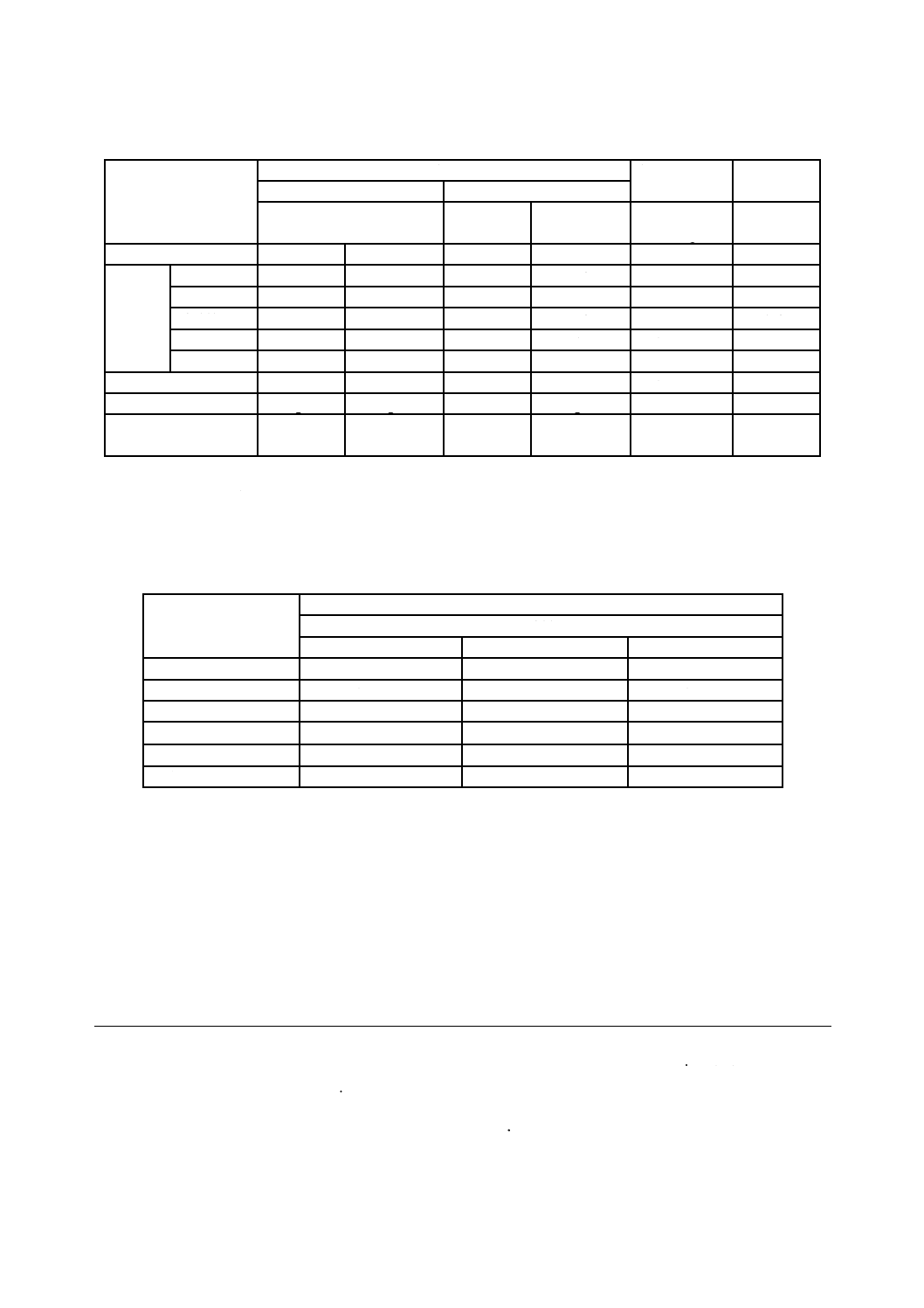L 1922:2016
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1 適用範囲························································································································· 1
2 引用規格························································································································· 1
3 用語及び定義 ··················································································································· 2
4 原理······························································································································· 3
5 対象ウイルス及び宿主細胞 ································································································· 3
6 安全上の警告 ··················································································································· 3
7 装置······························································································································· 4
8 使用器具の滅菌 ················································································································ 6
9 試薬及び培地 ··················································································································· 6
10 試験準備 ······················································································································ 10
10.1 凍結保存された宿主細胞の復元 ······················································································ 10
10.2 宿主細胞の継代培養 ····································································································· 10
10.3 ウイルス感染価測定用細胞培養 ······················································································ 10
10.4 試験ウイルス懸濁液の調製 ···························································································· 11
10.5 試験試料の準備 ··········································································································· 13
10.6 対照試験 ···················································································································· 14
11 試験手順 ······················································································································ 14
11.1 試験片の準備 ·············································································································· 14
11.2 試験片への試験ウイルス懸濁液の接種 ············································································· 15
11.3 作用時間 ···················································································································· 15
11.4 接種直後のウイルスの洗い出し ······················································································ 15
11.5 作用後のウイルスの洗い出し ························································································· 15
12 ウイルス洗い出し液の希釈系列の作製 ··············································································· 15
13 抗ウイルス感染価の測定 ································································································· 16
13.1 プラーク測定法 ··········································································································· 16
13.2 TCID50測定法 ············································································································· 16
14 抗ウイルス感染価の計算 ································································································· 16
14.1 プラーク測定法 ··········································································································· 16
14.2 TCID50測定法 ············································································································· 16
14.3 試験結果 ···················································································································· 18
15 試験報告書 ··················································································································· 18
附属書A(規定)試験対象ウイルス株及び宿主細胞 ··································································· 20
附属書B(規定)プラーク測定法 ··························································································· 21
附属書C(規定)TCID50測定法 ····························································································· 23
L 1922:2016 目次
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
附属書D(規定)培地の組成 ································································································· 24
附属書E(参考)ポリオウイルス ··························································································· 26
附属書F(参考)発育鶏卵を使用したウイルス感染価測定方法 ····················································· 27
附属書G(参考)抗ウイルス効果 ··························································································· 31
附属書H(参考)ラウンドロビン試験結果(1) ········································································ 32
附属書I(参考)ラウンドロビン試験結果(2) ········································································· 34
附属書JA(参考)JISと対応国際規格との対比表 ······································································ 37
L 1922:2016
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,一般社団法人繊維評価技術協議会(JTETC)
及び一般財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定すべきとの申出
があり,日本工業標準調査会の審議を経て,経済産業大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願又は実用新案権に抵触する可能性があることに注意
を喚起する。経済産業大臣及び日本工業標準調査会は,このような特許権,出願公開後の特許出願及び実
用新案権に関わる確認について,責任はもたない。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
L 1922:2016
繊維製品の抗ウイルス性試験方法
Textiles-Determination of antiviral activity of textile products
序文
この規格は,2014年に第1版として発行されたISO 18184を基とし,我が国の実態に対応するため,技
術的内容を変更して作成した日本工業規格である。
抗ウイルス製品は,繊維技術及びバイオ技術の両分野の技術が統合された製品として上市されているが,
その試験方法は統一されていない。
抗ウイルス繊維製品は,製品上に付着した感染性のあるウイルスの数を減少させる性能をもつ製品であ
る。この規格は,そのウイルスの活性抑制効果を定量的に測定する試験方法を規定する。
感染能力のあるウイルス数(感染価)を定量化する方法には,プラーク測定法及びTCID50測定法がある。
いずれの方法を使用するかはそれぞれの試験機関の経験及び利便性によって選択可能である。附属書Eに
ポリオウイルスを,附属書Fに従来から使用されてきた発育鶏卵法によるウイルス感染価測定方法を,附
属書Gに抗ウイルス効果を参考として記載した。また,附属書H及び附属書Iにラウンドロビン試験結果
を参考として記載した。
なお,この規格で点線の下線を施してある箇所は,対応国際規格を変更している事項である。変更の一
覧表にその説明を付けて,附属書JAに示す。
1
適用範囲
この規格は,繊維製品の抗ウイルス性試験について規定する。この規格で対象とする繊維製品は織物,
編物,不織布,綿,糸,ひもなどとする。この規格は,次のウイルスを対象とする(附属書A参照)。
− インフルエンザウイルス エンベロープをもつウイルスの一種であり,呼吸器感染症を引き起こすヒ
ト感染性ウイルス
− ネコカリシウイルス エンベロープをもたないウイルスの一種であり,重要な腸内病原体であるノロ
ウイルスの代替ウイルス
注記 この規格の対応国際規格及びその対応の程度を表す記号を,次に示す。
ISO 18184:2014,Textiles−Determination of antiviral activity of textile products(MOD)
なお,対応の程度を表す記号“MOD”は,ISO/IEC Guide 21-1に基づき,“修正している”
ことを示す。
2
引用規格
次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成する。これらの
引用規格は,その最新版(追補を含む。)を適用する。
JIS K 3600 バイオテクノロジー用語
2
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JIS K 8008 生化学試薬通則
JIS L 0803 染色堅ろう度試験用添付白布
注記 対応国際規格:ISO 105-F02:2009,Textiles−Tests for colour fastness−Part F02: Specification for
cotton and viscose adjacent fabrics(MOD)
ISO 3696,Water for analytical laboratory use−Specification and test methods
3
用語及び定義
この規格で用いる主な用語及び定義は,JIS K 3600及びJIS K 8008によるほか,次による。
3.1
ウイルス(virus)
細胞をもたずたんぱく質及び遺伝子物質からなり,特定の宿主細胞内で自己増殖できるもの。
3.2
ウイルスの活性(virus activity)
特定の宿主細胞内で自己増殖できる能力。
3.3
抗ウイルス性(antiviral property)
ウイルス表面のたんぱく質を変性させ得る又は構造に損傷を与え得る性能。
注記1 結果として,変性又は損傷したウイルスは宿主細胞のレセプターとの勘合性をなくし,活性
を低下させる。薬剤の性質によっては,核酸を変性させるものもある。さらに,エンベロー
プウイルスにおけるエンベロープの変性も同様である。
注記2 抗原反応の変化及びウイルスの構成要素の変化は,必ずしもウイルスの活性の低下を意味す
るものではない。
3.4
抗ウイルス薬剤(antiviral chemicals)
ウイルスの活性を減少させる無機又は有機の化学物質。
注記 有機系抗ウイルス薬剤は化学吸着し,ウイルス表面のタンパク質を変性させる。無機系の金属
含有物はラジカル反応によって発生したヒドロキシルラジカルがタンパク質中の水素原子を抜
き取り,その結果,タンパク質を破壊又は変質させる。
3.5
対照試料(reference cloth)
繊維上の試験ウイルスの安定性を確認するための布。
注記1 試験対象ウイルスが繊維上で安定であることを検証するための布地で,JIS L 0803に規定す
る綿100 %の添付白布3-1,3-2又は3-3とし,蛍光増白剤及び一切の加工剤を使用していな
いもの。
注記2 抗ウイルス加工した繊維製品の未加工品を対照試料としてもよい。
3.6
対照試験(control test of specimen)
試験片が宿主細胞に影響を与えないことを確認する試験。
注記 この試験は,ウイルスの使用を除き,全て実際の試験と同じ手順で行われる。
3
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
3.7
細胞変性効果[cytopathic effect(CPE) caused by virus]
細胞内でウイルスが増殖することに起因する細胞の形態変化又は細胞破壊。
3.8
ウイルス感染価(infectivity titre of virus)
単位体積当たりの感染性のあるウイルスの数。
3.9
プラーク(plaque)
一つの感染性ウイルス粒子が細胞に感染・増殖することによって,半固体培地下の単層細胞中で形成さ
れる細胞溶解部分。
注記 溶解部分は染色されないため透明な斑点として観察できる。
3.10
プラーク形成単位,PFU(plaque forming units)
単位体積当たりのプラーク数。
3.11
プラーク測定法(plaque assay)
ある希釈濃度でのプラーク数から求められるウイルス感染価測定方法。
3.12
TCID50測定法(TCID50 method)
培養細胞の50 %に細胞変性効果が認められる希釈倍率から求められるウイルス感染価測定方法。
注記 TCID50は,“Median tissue culture infectious dose”の略称である。
4
原理
抗ウイルス性は,ウイルスを試験片に接触させ,特定時間後の試験片のウイルス感染価を測定し,その
減少の度合いを抗ウイルス試験布と対照試料とのウイルス感染価の常用対数値の差によって求める。ウイ
ルス感染価測定方法は,プラーク測定法(3.11)及びTCID50測定法(3.12)とする。いずれの測定方法を
使用するかは,その試験機関の経験及び利便性による。
5
対象ウイルス及び宿主細胞
使用するウイルスは,附属書Aに規定するインフルエンザウイルス及びネコカリシウイルスとする。ま
た,附属書Aには,ウイルスに対応して使用する宿主細胞を規定する。試験に使用するウイルスは,繊維
製品の最終用途に応じて,いずれか一方又は両方を選定する。
6
安全上の警告
この規格は,取扱い方によっては,健康及び環境に害を及ぼす感染性ウイルス及び薬品を使用する。こ
の規格は,単に技術的に適切な方法を規定しているものであり,この規格の使用者は,この規定に従って
いても,試験のどの段階においても健康及び環境に関する法的義務を免除されるものではない。
さらに,次の重要な注意事項がある。この規格で使用するウイルスは,世界保健機関(WHO)の実験室
バイオセーフティ指針にあるバイオセーフティレベル2に該当するものである。試験の担当者は,ウイル
ス学的技術の訓練を受け,十分な知識と経験をもって実施する必要がある。また,我が国の安全基準に従
4
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
い,適切な安全対策をとることが義務付けられる。
7
装置
抗ウイルス性試験に用いる装置は,次による。
7.1
高圧蒸気滅菌器(オートクレーブ) 121 ℃±2 ℃,圧力103 kPa±5 kPaでの使用が可能なもの。
7.2
乾熱滅菌器 180 ℃±2 ℃及び160 ℃±2 ℃での使用が可能なもの。
7.3
メスフラスコ 容量が1 Lのもの。
7.4
天びん(秤) 計測値の許容範囲が±0.01 gの精度をもつもの。
7.5
ガラスメスピペット ガラス製で,50 mL±0.5 mL,25 mL±0.25 mL,10 mL±0.1 mL及び5 mL±0.05
mLの容量のもの。
7.6
プラスチックピペット 50 mL±0.5 mL,25 mL±0.25 mL,10 mL±0.1 mL及び5 mL±0.05 mLの容
量のもの。
7.7
ピペッター ガラス製又はプラスチック製のピペットを装着可能なもの。
7.8
マイクロピペット ガラス製又はプラスチック製のチップが装着可能で,この試験に最も適した容
積をもち,許容誤差が0.5 %以下のもの。
7.9
ウォーターバス 37 ℃±2 ℃,50 ℃±2 ℃及び56 ℃±2 ℃の温度を保つことができるもの。
7.10 ボルテックスミキサー 微生物試験用のもの。
7.11 冷凍庫 −80 ℃及び−20 ℃の温度を保つことができるもの。
7.12 液体窒素槽 −196 ℃に保つことができるもの。
7.13 メンブランフィルタ 孔径0.22 μmのもの。
7.14 保冷庫 2 ℃〜8 ℃の温度を保つことができるもの。
7.15 pHメータ ガラス電極を検出器とするもの。
7.16 倒立顕微鏡 培養細胞観察用のもの。
7.17 ピンセット 滅菌処理が可能なもの。
7.18 遠心分離機 温度4 ℃に設定可能で,約9 800 m/s2(1 000 g)で使用可能なもの。
7.19 安全キャビネット 微生物試験対応のもので,バイオセーフティレベル2のもの。
注記 安全キャビネットは,JIS K 3800に適合するものか又はこれと同等の性能をもつものがよい。
7.20 バイアル瓶 ねじ口付き容量30 mLのガラス製で,パッキンが四ふっ化エチレン樹脂製又はシリコ
ン製であり,キャップがポリプロピレン製のもの。
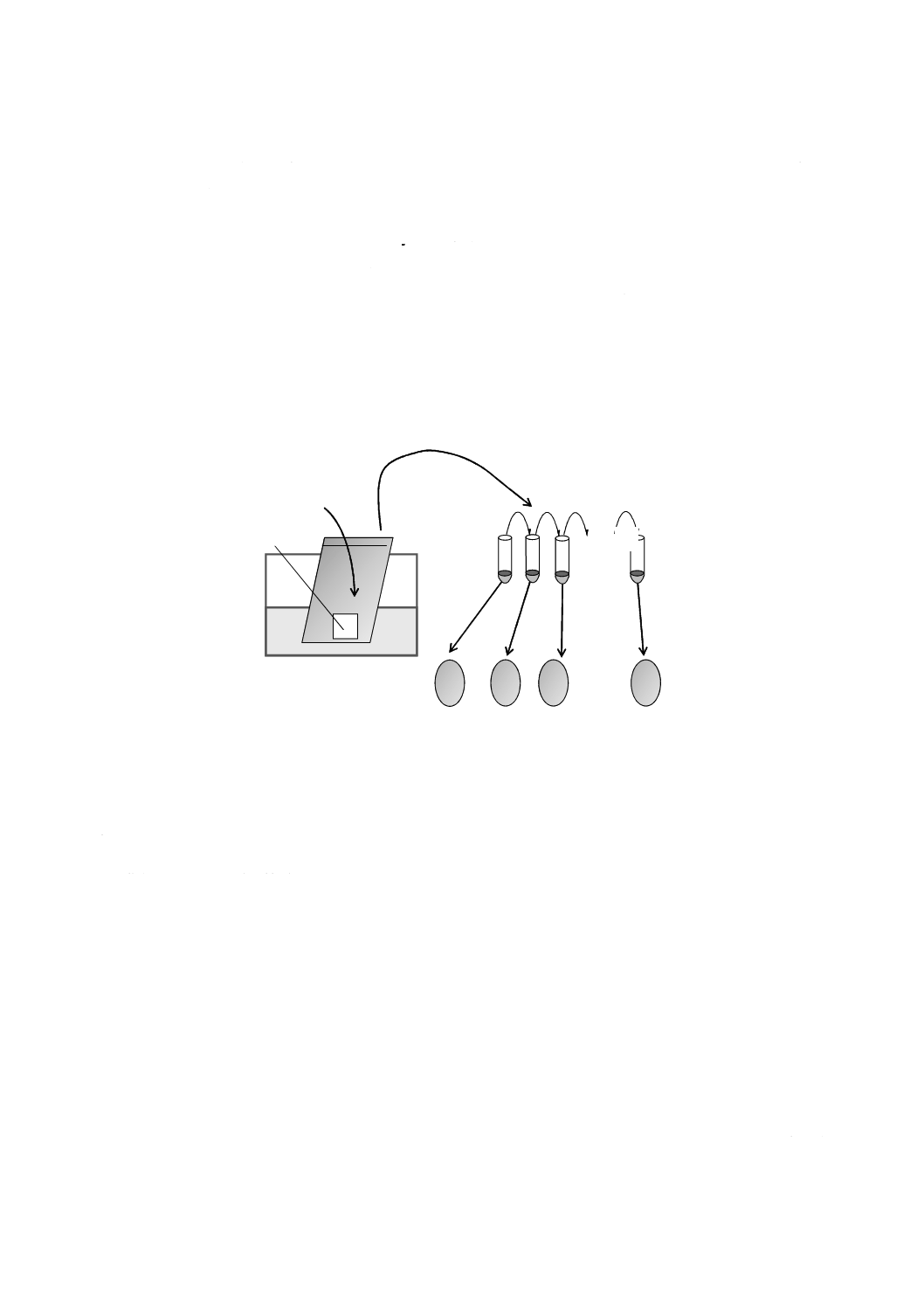
7.21 96穴マイクロプレート TCID50測定用で,γ線滅菌1)済みのもの(図1参照)。

5
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図1−TCID50測定法で使用する96穴マイクロプレートの例
7.22 6穴プラスチックプレート プラーク感染価測定用で,γ線滅菌1)済みのもの(図2参照)。
図2−6穴プラスチックプレートの例
7.23 フラスコ ベントキャップ付きで,底面積75 cm2の付着性細胞培養用のもの。ベントキャップは,
0.2 μmのメンブランフィルタ付きで,無菌でガス交換ができ,γ線滅菌1)済みのもの(図3参照)。
図3−細胞培養用のフラスコの例
6
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
注1) γ線滅菌法のほか,エチレンオキサイド滅菌法によるもの及び無菌生産製品があり,いずれを
使用してもよい。
7.24 CO2インキュベーター 34 ℃±2 ℃及び37 ℃±2 ℃の温度で,炭酸ガス濃度5 %の環境を保てる
もの。
7.25 インキュベーター 25 ℃±2 ℃,34 ℃±2 ℃及び37 ℃±2 ℃の温度を保てるもの。
7.26 遠沈管 遠心分離を行うときに使用するガラス又はプラスチック製の容器。
7.27 培地瓶
7.28 試験管
7.29 ビーカー
8
使用器具の滅菌
ガラス容器,プラスチック製器具2)など細胞組織,使用薬剤,試験試料などに接触するものは全て滅菌
する。滅菌方法は,次の高圧蒸気又は乾熱のいずれかの方法による。
− 高圧蒸気滅菌法:オートクレーブ(7.1)によって設定温度121 ℃及び設定圧力103 kPaで15分間加
熱し,滅菌する。
− 乾熱滅菌法:乾熱滅菌器(7.2)によって設定温度180 ℃で30分間,又は設定温度160 ℃で2時間加
熱し,滅菌する。
注2) プラスチック製器具は,耐熱性のあるものを使用するか,又は無菌生産製品を使用してもよい。
9
試薬及び培地
試薬は,分析用品質又は微生物試験に用いる品質のものとする。培養培地などの薬剤は,市場で購入可
能なものもあり,可能な限りそれら市販品の使用を推奨する。
9.1
水 ISO 3696に規定する3級のもの又は微生物学用培地の作製に使用できる分析用品質のもので,
イオン交換,蒸留,逆浸透,限外ろ過などを単独又はその組合せによって精製したもの。
9.2
イーグル培地(EMEM) 組成が附属書Dによるもの。市販品が入手可能である。市販品を使用す
る場合,附属書Dの組成で含まれていない成分がある場合は追加する。
9.3
7.5 %炭酸水素ナトリウム溶液
9.3.1
炭酸水素ナトリウム 75 gを培地瓶に入れ,培地瓶の蓋を閉めて高圧蒸気滅菌する。
9.3.2
水(9.1)1 000 mLを高圧蒸気滅菌する。
9.3.3
炭酸水素ナトリウムと水(9.3.2)1 000 mLを混合し,溶解する。
9.4
細胞固定用ホルマリン溶液
9.4.1
37 %ホルムアルデヒド溶液100 mLを準備する。
9.4.2
9.4.1の溶液に,水(9.1)900 mLを加える。
注記 ホルマリン溶液に替えて,同等の性能をもつ他の溶液を使用してもよい。
9.5
細胞染色用メチレンブルー溶液
9.5.1
1 Lのメスフラスコ(7.3)を準備し,次の成分を入れる。
− 水(9.1)
800 mL
− メチレンブルー
0.375 g
− 1 mol/Lの水酸化ナトリウム溶液
62.5 μL
9.5.2
9.5.1の成分を溶解,混合し,水(9.1)を加えて全量を1 000 mLとする。
7
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9.6
非働化済ウシ胎児血清
9.6.1
凍結保存されたウシ胎児血清を37 ℃の温度に設定されたウォーターバス(7.9)によって解凍する。
9.6.2
ウォーターバスによって56 ℃で,30分間加温し,非働化する。
9.6.3
適量ずつ試験管に分注し,−20 ℃以下の温度に設定された冷凍庫(7.11)に入れ,保管する。
9.6.4
使用直前に,37 ℃の温度に設定されたウォーターバスによって解凍する。
9.7
細胞培養に使用する増殖培地
9.7.1
1 Lのメスフラスコ(7.3)を準備し,次の成分を入れる。
− 水(9.1)
800 mL
− カナマイシン硫酸塩
60 mg
− イーグル培地(EMEM) 9.53 g又はロズウェルパーク記念研究所培地(RPMI) 10.4 g
注記 RPMIは,Roswell Park Memorial Instituteに由来する。
9.7.2
9.7.1の成分を溶解,混合し,水(9.1)を加えて全量を1 000 mLとする。
9.7.3
9.7.2の混合溶液を,孔径0.22 μmのメンブランフィルタ(7.13)によって,ろ過滅菌する。
9.7.4
次いで,9.7.3の混合溶液に7.5 %炭酸水素ナトリウム溶液(9.3)15 mL及び非働化済ウシ胎児血清
(9.6)100 mLを加える。
注記 市販品のEMEMにL-グルタミンが含まれていない場合は,附属書Dに規定する組成によって
混合し,使用するのがよい。
9.8
細胞培養に使用する維持培地
9.8.1
1 Lのメスフラスコ(7.3)を準備し,次の成分を入れる。
− 水(9.1)
800 mL
− カナマイシン硫酸塩
60 mg
− EMEM
9.53 g
9.8.2
9.8.1の成分を溶解,混合し,水(9.1)を加えて全量を1 000 mLとする。
9.8.3
9.8.2の混合溶液を,孔径0.22 μmのメンブランフィルタ(7.13)によって,ろ過滅菌する。
9.8.4
9.8.3の混合溶液に,7.5 %炭酸水素ナトリウム溶液(9.3)15 mLを加える。
注記 市販品のEMEMにL-グルタミンが含まれていない場合は,附属書Dに規定する組成によって
混合し,使用するのがよい。
9.9
2倍濃縮維持培地(9.8)
9.9.1
1 Lのメスフラスコ(7.3)を準備し,次の成分を入れる。
− 水(9.1)
800 mL
− カナマイシン硫酸塩
120 mg
− EMEM
19.06 g
9.9.2
9.9.1の成分を溶解,混合し,水(9.1)を加えて全量を1 000 mLとする。
9.9.3
9.9.2の混合溶液を,孔径0.22 μmのメンブランフィルタ(7.13)によって,ろ過滅菌する。
9.10 0.01 mol/Lのりん酸緩衝生理食塩水[PBS(-)]
9.10.1 1 Lのメスフラスコ(7.3)を準備し,次の成分を入れる。
− 水(9.1)
800 mL
− 塩化ナトリウム
8 g
− 塩化カリウム
0.2 g
− りん酸水素二ナトリウム12水和物
2.9 g
8
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
− りん酸二水素カリウム
0.2 g
9.10.2 9.10.1の成分を溶解,混合し,水(9.1)を加えて全量を1 000 mLとする。
9.10.3 9.10.2の混合溶液を培地瓶(7.27)に移し,オートクレーブ(7.1)によって121 ℃,103 kPaの条
件で高圧蒸気滅菌を行う。
9.11 ウシすい(膵)臓由来トリプシン及びPBS (-) 混合液
9.11.1 ビーカーを準備し,次の成分を入れる。
− 0.01 mol/Lのりん酸緩衝生理食塩水[PBS(-)](9.10)
100 mL
− ウシすい(膵)臓由来トリプシン
1.0 g
9.11.2 9.11.1の成分を2時間溶解し,混合する。
9.11.3 9.11.2の混合溶液を,孔径0.22 μmのメンブランフィルタ(7.13)によって,ろ過滅菌する。適量
ずつ分注し,すぐ使用しないものは−80 ℃以下の温度に設定された冷凍庫(7.11)に入れ,保存する。
9.11.4 試験管を準備し,次の成分を入れる。
− 0.01 mol/Lのりん酸緩衝生理食塩水[PBS(-)](9.10)
9 mL
− ウシすい(膵)臓由来トリプシン及びPBS(-) 混合液 (9.11) 1 mL
9.11.5 9.11.4の成分を十分に溶解し,混合する。
9.11.6 混合溶液を適量ずつ分注し,−20 ℃以下の温度に設定された冷凍庫(7.11)に入れ,保存する。
9.11.7 使用直前に37 ℃の温度に設定されたウォーターバス(7.9)によって解凍する。
9.12 結晶トリプシン及びエチレンジアミン四酢酸(EDTA)溶液
9.12.1 1 Lのメスフラスコ(7.3)を準備し,次の成分を入れる。
− 0.01 mol/Lのりん酸緩衝生理食塩水[PBS(-)](9.10)
800 mL
− 結晶トリプシン
2.5 g
− カナマイシン硫酸塩
0.1 g
− ストレプトマイシン硫酸塩
0.1 g
− アムホテリシンB
2 mg
− EDTA
0.014 mol
9.12.2 9.12.1の成分を溶解,混合し,0.01 mol/Lのりん酸緩衝生理食塩水[PBS(-)](9.10)を加えて全量
を1 000 mLとする。
9.12.3 9.12.2の混合溶液を,孔径0.22 μmのメンブランフィルタ(7.13)によって,ろ過滅菌する。
9.12.4 混合溶液を適量ずつ分注し,−20 ℃以下の温度に設定された冷凍庫(7.11)に入れ,保存する。
9.12.5 使用直前に,37 ℃の温度に設定されたウォーターバス(7.9)によって解凍する。
注記 結晶トリプシン及びEDTA溶液は市場で購入できる。
なお,購入したものが9.12.1と成分が異なる場合でも適切な検証後に使用可能である。
9.13 ジエチルアミノエチルデキストラン(DEAE-Dextran)溶液
9.13.1 1 Lのメスフラスコ(7.3)を準備し,次の成分を入れる。
− 水(9.1)
800 mL
− DEAE-Dextran
20 g
9.13.2 9.13.1の成分を溶解,混合し,水(9.1)を加えて全量を1 000 mLとする。
9.13.3 9.13.2の混合溶液を,孔径0.22 μmのメンブランフィルタ(7.13)によって,ろ過滅菌する。
9.14 寒天培地
寒天培地は,プラーク測定法に使用するものであり,A液及びB液を次の処方によって準備し,使用直
9
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
前に十分に混合する。
9.14.1 A液
9.14.1.1 1 Lの滅菌済み培地瓶(7.27)を準備し,次の成分を入れて十分混合する。
− 2倍濃縮維持培地(9.9)
1 000 mL
− DEAE-Dextran溶液(9.13)
10 mL
− 7.5 % 炭酸水素ナトリウム溶液(9.3)
40 mL
9.14.1.2 インフルエンザウイルスのプラーク測定法の場合だけ,ウシすい(膵)臓由来トリプシン(9.11)
を3.0 mL加える。
9.14.1.3 9.14.1.1及び9.14.1.2の混合溶液を37 ℃の温度に設定されたウォーターバス(7.9)に入れ,使用
直前まで保温する。
9.14.2 B液
9.14.2.1 2 Lの培地瓶(7.27)を準備し,次の成分を入れて十分混合する。
− 水(9.1)
1 000 mL
− 細胞培養用寒天
15 g
9.14.2.2 9.14.2.1の混合溶液をオートクレーブ(7.1)によって121 ℃,103 kPaの条件で,15分間高圧蒸
気滅菌する。
9.14.2.3 9.14.2.2の混合溶液を50 ℃の温度に設定されたウォーターバス(7.9)に入れ,使用直前まで保
温する。
9.15 SCDLP培地
SCDLP培地は,繊維上のウイルスの洗い出し処理及び試験試料に加工されている薬剤の不活性化のため
に使用する。
9.15.1 1 Lの培地瓶(7.27)を準備し,次の成分を入れて溶解し,十分混合する。
− 水(9.1)
1 000 mL
− カゼイン製ペプトン
17.0 g
− 大豆製ペプトン
3.0 g
− 塩化ナトリウム
5.0 g
− りん酸水素二カリウム
2.5 g
− グルコース
2.5 g
− レシチン
1.0 g
− 非イオン界面活性剤[ポリソルベート80(Tween 80)]
7.0 g
9.15.2 9.15.1の混合溶液を25 ℃の温度に設定されたウォーターバス(7.9)によって水酸化ナトリウム溶
液又は塩酸溶液によってpH 7.0±0.2,25 ℃に調製する。
9.15.3 9.15.2の調製液をオートクレーブ(7.1)によって,121 ℃,103 kPaの条件下で15分間高圧蒸気滅
菌を行う。
9.16 TCID50測定法に用いる維持培地
9.16.1 1 Lの培地瓶(7.27)を準備し,次の成分を入れて溶解し,十分混合する。
− 維持培地(9.8)
1 000 mL
− ウシすい(膵)臓由来トリプシン(9.11)
3.0 mL
10
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
10 試験準備
10.1 凍結保存された宿主細胞の復元
凍結保存された宿主細胞は,解凍し,培養を行う。その手順は,次による。
10.1.1 凍結保存された宿主細胞懸濁液を37 ℃の温度に設定されたウォーターバス(7.9)によって,急速
に融解する。
10.1.2 フラスコ(7.23)に増殖培地(9.7)20 mLを加える。
10.1.3 10.1.2のフラスコに10.1.1によって融解した細胞を1アンプル分全量を入れる。
10.1.4 10.1.3のフラスコを,37 ℃の温度に設定されたCO2インキュベーター(7.24)に入れ,24時間±2
時間培養する。
10.1.5 倒立顕微鏡(7.16)によってフラスコ(10.1.4)底部に細胞が吸着していることを確認する。確認
できれば次の手順を行う。確認できない場合は,更に培養を継続する。
10.1.6 10.1.5のフラスコ内の増殖培地を全量除去する。
10.1.7 10.1.6のフラスコ内に新たに増殖培地(9.7)20 mLを加える。
10.1.8 10.1.7のフラスコを,37 ℃の温度に設定されたCO2インキュベーター(7.24)に入れ,48時間±2
時間培養する。
10.1.9 培養後,細胞が10.1.8のフラスコの底面に均一に分布していることを倒立顕微鏡(7.16)によって
確認する。細胞の増殖が不十分な場合は,十分に増殖したことが確認できるまで継続する。
10.1.10 次に,10.2の手順によって,継代培養を行う。
10.2 宿主細胞の継代培養
宿主細胞は,継代培養する。継代培養の手順は,次による。
10.2.1 10.1.9で単層培養した細胞が,フラスコの底面に均一に分布していることを倒立顕微鏡(7.16)に
よって確認する。確認後,増殖培地を除去する。
10.2.2 次に,0.01 mol/Lのりん酸緩衝生理食塩水[PBS(-)]5 mLを加え,この溶液によってフラスコ底部
上に増殖した細胞の表面を洗浄後,加えたPBS(-)を除去する。この操作を3回繰り返す。
10.2.3 10.2.2のフラスコに結晶トリプシン及びEDTA溶液(9.12)1 mLを加え,細胞表面全体に行き渡ら
せた後,余分な結晶トリプシン及びEDTA溶液を除去する。
10.2.4 10.2.3のフラスコを37 ℃の温度に設定されたCO2インキュベーター(7.24)に入れ,10分間±1
分間保温する。
10.2.5 10.2.4のフラスコ内の細胞が剝がれ始めたことを目で確認し,フラスコ側面を軽くたたき,細胞を
分散させる。
10.2.6 10.2.5のフラスコに増殖培地(9.7)5 mLを加える。組織を傷付けないようにピペットによってピ
ペッティングし,細胞を分散させる。
10.2.7 新らたな細胞培養用フラスコ(7.23)に増殖培地20 mLを加えたものを準備する。
10.2.8 10.2.7のフラスコ内にピペットによって,10.2.6の細胞懸濁液を1 mL加える。
10.2.9 蓋を締めたフラスコを37 ℃の温度に設定されたCO2インキュベーター(7.24)に入れ,5日間3)
培養する。
注記 継代培養を繰り返し行う場合は,10.2.1〜10.2.9の工程を繰り返す。
注3) 培養期間は,必要に応じて変更してもよい。
10.3 ウイルス感染価測定用細胞培養
プラーク測定法又はTCID50測定法のために,6穴プラスチックプレート又は96穴マイクロプレートに
11
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
よって,細胞培養する。
10.3.1 培地瓶(7.27)に増殖培地(9.7)を20 mL入れ,ピペットによって10.2.6の細胞懸濁液を1 mL加
える。
10.3.2 プラーク測定法用の6穴プラスチックプレート(7.22)には,10.3.1の細胞懸濁液を1穴当たり,3
mL加える。
10.3.3 TCID50測定法用の96穴マイクロプレート(7.21)には,10.3.1の細胞懸濁液を1穴当たり,0.1 mL
加える。
10.3.4 10.3.2の6穴プラスチックプレート又は10.3.3の96穴マイクロプレートを,37 ℃の温度に設定さ
れたCO2インキュベーター(7.24)に入れて,5日間4)培養する。
注4) 培養期間は,必要に応じて変更してもよい。
10.3.5 感染価の測定に使用する前に,倒立顕微鏡(7.16)によって,細胞が均一に分布していることを確
認する。
10.4 試験ウイルス懸濁液の調製
10.4.1 概要
ウイルスは凍結保存されているので,その融解及び培養を行う。
10.4.2 インフルエンザウイルス
10.4.2.1 凍結保存されたウイルス懸濁液を37 ℃の温度に設定されたウォーターバス(7.9)によって,急
速に融解する。
10.4.2.2 細胞が単層培養された10.2.9のフラスコから増殖培地を除去する。
10.4.2.3 10.4.2.2のフラスコ内に5 mLの維持培地(9.8)を加えて細胞の表面を洗浄後,維持培地を除去す
る。この洗浄操作を2回繰り返す。
10.4.2.4 新しい試験管を準備する。
10.4.2.5 10.4.2.4の試験管に10.4.2.1の融解したインフルエンザウイルス懸濁液を入れ,維持培地(9.8)
によって希釈し,103 PFU(プラーク形成単位であり,以下,PFUという。)/mL〜104 PFU/mL又はTCID50/mL
に調製する。
10.4.2.6 10.4.2.3のフラスコ内の細胞の表面上に10.4.2.5で調製されたインフルエンザウイルス懸濁液1
mLを接種し,細胞表面全体に広げる。
10.4.2.7 10.4.2.6のフラスコを34 ℃の温度に設定されたCO2インキュベーター(7.24)に入れ,1時間保
温し,細胞にウイルスを吸収させる。
10.4.2.8 10.4.2.7のフラスコ内に維持培地(9.8)20 mLを入れ,更にウシすい(膵)臓由来トリプシン及
びPBS(-)混合液(9.11)30 μLを加える。
10.4.2.9 10.4.2.8のフラスコを34 ℃の温度に設定されたCO2インキュベーター(7.24)に入れ,フラスコ
内のインフルエンザウイルスを1日〜3日間増殖させる。
10.4.2.10 倒立顕微鏡(7.16)によって細胞変性効果を観察し,インフルエンザウイルスの増殖を確認する。
インフルエンザウイルスの増殖が確認された場合は,次のステップへ進む。
10.4.2.11 遠沈管(7.26)に,培養されたウイルス懸濁液を入れる。
10.4.2.12 遠心分離機(7.18)によって,10.4.2.11のウイルス懸濁液を4 ℃の温度で15分間,約9 800 m/s2
(1 000 g)の条件下で遠心分離する。
10.4.2.13 遠心分離後,遠沈管から上澄みを取る。これを,インフルエンザウイルスの懸濁液とする。試
験管に適量を分注し,−80 ℃の温度に設定された冷凍庫(7.11)に入れ,凍結保存する。
12
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
10.4.2.14 プラーク測定法又はTCID50測定法によって,ウイルス懸濁液の濃度が107 PFU/mL以上又は
TCID50/mL以上かどうかを確認する。ウイルス懸濁液の濃度が107 PFU/mL未満又はTCID50/mL未満の場
合は,再度調製する。
10.4.2.15 10.4.2.14で凍結保存したウイルス懸濁液を使用直前に,37 ℃の温度に設定されたウォーターバ
ス(7.9)によって,急速に融解する。
10.4.2.16 これを試験ウイルス懸濁液とする。直ちに使用しない場合は,4 ℃の温度に設定された保冷庫
(7.14)に入れ,保存する。
注記1 10.4.2.16の試験ウイルス懸濁液は,必要に応じて使用直前に,水(9.1)で10倍希釈しても
よい。
注記2 10倍希釈後の試験ウイルス懸濁液の濃度は,1×107 PFU/mL〜5×107 PFU/mL又はTCID50/mL
であることが望ましい。
10.4.3 ネコカリシウイルス
10.4.3.1 凍結保存されたウイルス懸濁液を37 ℃の温度に設定されたウォーターバス(7.9)によって,急
速に融解する。
10.4.3.2 細胞が単層培養された10.2.9のフラスコから増殖培地を除去する。
10.4.3.3 10.4.3.2のフラスコ内に,5 mLの維持培地(9.8)を加えて培養細胞の表面を洗浄後,維持培地を
除去する。この洗浄操作を2回繰り返す。
10.4.3.4 新しい試験管を準備する。
10.4.3.5 10.4.3.4の試験管に10.4.3.1で融解したネコカリシウイルス懸濁液を入れ,維持培地(9.8)によ
って希釈し,105 PFU/mL〜106 PFU/mL又はTCID50/mLに調製する。
注記 ウイルス懸濁液濃度は,必要に応じて変更してもよい。
10.4.3.6 10.4.3.3のフラスコ内の細胞の表面上に,10.4.3.5で調製されたネコカリシウイルス懸濁液1 mL
を接種し,細胞表面全体に広げる。
10.4.3.7 10.4.3.6のフラスコを37 ℃の温度に設定されたCO2インキュベーター(7.24)に入れ,1時間保
温し,細胞にウイルスを吸収させる。
10.4.3.8 10.4.3.7のフラスコ内に,維持培地(9.8)20 mLを追加する。
注記 加える維持培地は,必要に応じて変更してもよい。
10.4.3.9 10.4.3.8のフラスコを37 ℃の温度に設定されたCO2インキュベーター(7.24)に入れ,フラスコ
内のネコカリシウイルスを1日〜3日間増殖させる。
10.4.3.10 倒立顕微鏡(7.16)によって細胞変性効果を観察し,ネコカリシウイルスの増殖を確認する。
ネコカリシウイルスの増殖が確認された場合は,次のステップへ進む。
10.4.3.11 遠沈管(7.26)に,培養されたウイルス懸濁液を入れる。
10.4.3.12 遠心分離機(7.18)によって,10.4.3.11のウイルス懸濁液を4 ℃の温度で15分間,約9 800 m/s2
(1 000 g)の条件下で遠心分離する。
10.4.3.13 遠心分離後,遠沈管から上澄み液を取る。これを,ネコカリシウイルスの懸濁液とする。試験
管に適量を分注し,−80 ℃の温度に設定された冷凍庫(7.11)に入れ,凍結保存する。
10.4.3.14 プラーク測定法又はTCID50測定法によって,ネコカリシウイルス懸濁液の濃度が107 PFU/mL
以上又はTCID50/mL以上かどうかを確認する。ウイルス懸濁液の濃度が107 PFU/mL未満又はTCID50/mL
未満の場合は,再度調製する。
10.4.3.15 10.4.3.14の凍結保存したウイルス懸濁液を使用直前に,37 ℃の温度に設定されたウォーターバ
13
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ス(7.9)によって,急速に融解する。これを試験ウイルス懸濁液とする。直ちに使用しない場合は,4 ℃
の温度に設定された保冷庫(7.14)に入れ,保存する。
注記1 10.4.3.15の試験ウイルス懸濁液は,必要に応じて使用直前に,水(9.1)で10倍希釈しても
よい。
注記2 10倍希釈後の試験ウイルス懸濁液の濃度は,1×107 PFU/mL〜5×107 PFU/mL又はTCID50/mL
であることが望ましい。
10.4.4 試験ウイルス懸濁液の感染価
試験ウイルスの感染価の測定は,次の手順による。
10.4.4.1 ウイルス懸濁液のための希釈系列の準備
10.4.4.1.1 新しい試験管に維持培地(9.8)1.8 mLを入れ,氷水浴中で維持する。
10.4.4.1.2 10.4.4.1.1の試験管内に,10.4.2.16及び10.4.3.15のウイルス懸濁液0.2 mLを加え,ボルテック
スミキサー(7.10)によって試験管を十分にかくはんする。
注記 この操作によって,ウイルス懸濁液は10倍希釈される。
10.4.4.1.3 新しい試験管に維持培地(9.8)1.8 mLを入れ,氷水浴中で維持する。
10.4.4.1.4 10.4.4.1.3の試験管に10.4.4.1.2の溶液0.2 mLを追加し,それらをよく振とうする。
注記 この操作によって,ウイルス懸濁液は100倍希釈される。
10.4.4.1.5 この手順を繰り返し,ウイルス懸濁液の希釈系列を準備する。
注記1 TCID50測定法の場合は,8穴(ウェル)全てが感染する希釈点及び8穴(ウェル)全てが感
染しない希釈点を準備する必要がある。
注記2 ウイルス感染価が108TCID50/mLの場合は,TCID50測定法に供するウイルス懸濁液の希釈系
列は10−8までが必要となる。
10.4.4.2 ウイルス感染価の測定
10.4.4.2.1 プラーク測定法
プラーク測定法によるウイルス感染価の測定は,附属書Bによる。
10.4.4.2.2 TCID50 測定法
TCID50 測定法によるウイルス感染価の測定は,附属書Cによる。
10.5 試験試料の準備
10.5.1 対照試料
JIS L 0803に規定する綿100 %の添付白布3-1,3-2又は3-3,若しくは未加工布を,洗剤及び蛍光漂白剤
を使用せず,60 ℃,10分間の洗濯を10回繰り返す。
注記 抗ウイルス加工繊維製品の未加工品を対照試料としてもよい。
10.5.2 試験片の採取
10.5.2.1 試験片は,試料を20 mm×20 mmの大きさに裁断し,これを積み重ねて質量を0.40 g±0.05 gと
する。試料が糸の場合は,糸を束ねて約20 mmの長さに裁断し,0.40 g±0.05 gの質量とする。
10.5.2.2 試験片の数は,抗ウイルス試料を9検体,対照試料を12検体準備する。
注記 対照試料の6検体及び抗ウイルス試料の6検体は,対照試験に使用する。また,対照試料の3
検体は,試験ウイルス懸濁液接種直後の感染価測定に使用する。残りの抗ウイルス試料の3検
体及び対照試料の3検体は,この試験で所定時間作用後のウイルス感染価の測定に使用する。
10.5.3 試験片の滅菌
10.5.3.1 採取した試験片をバイアル瓶(7.20)に1検体ずつ入れる。これらを金網かごに入れ,金網かご
14
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
の上部全体をアルミニウムはく(箔)で覆う。また,キャップは,別にアルミニウムはく(箔)で包む。
10.5.3.2 10.5.3.1の試験片をオートクレーブ(7.1)に入れ,121 ℃,103 kPaの条件で,15分間高圧蒸気
滅菌する。
10.5.3.3 試験片をオートクレーブから取り出した後,安全キャビネット(7.19)内でアルミニウムはく(箔)
を外して,60分間風乾する。次いで,バイアル瓶(7.20)内に結露がないこと確認し,バイアル瓶(7.20)
のキャップを締める。
注記 抗ウイルス剤又は繊維製品の特性によって高圧蒸気滅菌が適さない場合は,他の適切な滅菌方
法を選択することができる。
10.6 対照試験
10.6.1 概要
対照試験の目的は,試験試料に由来する加工剤活性の抑制効果を確認することである。試験試料に由来
する加工剤活性の抑制効果とは,ウイルスの洗い出し操作の過程において溶出の可能性がある加工剤が細
胞毒性を示さないこと,ウイルスへの細胞の感受性の低下を引き起こさないこと,及び抗ウイルス活性が
不活性化されていることを意味する。
10.6.2 細胞毒性効果の確認
10.6.2.1 10.5.3で滅菌された抗ウイルス繊維製品試料及び標準布試料の各3検体に,SCDLP培地(9.15)
20 mLを加えてバイアル瓶(7.20)のキャップを締め,ボルテックスミキサー(7.10)によって5秒間を5
回繰り返して,かくはんする。
10.6.2.2 附属書B又は附属書Cによって細胞の損傷の有無を確認し,損傷が確認されない場合は,次のス
テップへ進む。
注記 細胞の損傷が認められた場合は,洗い出し液の組成を修正・変更するか,又は洗い出し液の増
量を行うのがよい。
10.6.3 ウイルスへの細胞の感受性及び抗ウイルス活性の不活化の確認
10.6.3.1 10.5.3で滅菌した抗ウイルス繊維製品試料及び標準布試料の各3検体に,SCDLP培地(9.15)20 mL
を加えてバイアル瓶(7.20)のキャップを締め,ボルテックスミキサー(7.10)によって5秒間を5回繰り
返して,かくはんする。
10.6.3.2 新しい試験管に10.6.3.1の洗い出し液5 mLを入れる。
10.6.3.3 この試験管に4×104 PFU/mL〜6×104 PFU/mL又はTCID50/mLの濃度に調製したウイルス懸濁液
50 μLを加える。
10.6.3.4 この試験管を25 ℃で30分間静置する。
10.6.3.5 附属書B又は附属書Cによって,ウイルス感染価を求める。
注記 TCID50測定法の場合は,希釈系列の作製のときに10.6.3.1の洗い出し液を用いる。
10.6.3.6 試験の検証のための条件
log(対照試料のPFU/mL又はTCID50/mL)−log(抗ウイルス試料のPFU/mL又はTCID50/mL)≦0.5
注記 上記の式の値が0.5を超える場合は,洗い出し液の組成を修正・変更するか,又は洗い出し液
の増量を行うのがよい。
11 試験手順
11.1 試験片の準備
10.5で準備した試験片の入ったバイアル瓶(7.20)を準備する。
15
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
11.2 試験片への試験ウイルス懸濁液の接種
10.4で調製した試験ウイルス懸濁液をピペットによって正確に0.2 mL採取し,バイアル瓶の中の試験片
の数箇所に接種後,バイアル瓶のキャップを締める。
11.3 作用時間
11.2の試験ウイルス懸濁液を接種した試験片の入ったバイアル瓶を25 ℃に設定したインキュベーター
(7.25)内で,2時間静置する。
注記 作用時間は,受渡当事者間の合意によって24時間を限度に変更してもよい。
11.4 接種直後のウイルスの洗い出し
11.2の対照試料3検体の入ったバイアル瓶に,SCDLP培地(9.15)20 mLを加える。その後,キャップ
を締め,ボルテックスミキサー(7.10)によって,5秒間を5回繰り返してかくはんし,各試験片からウイ
ルスを洗い出す。
注記1 10.6の対照試験において,洗い出し液の組成を修正,変更するか,又は洗い出し液の増量を
行った場合には,それと同じ条件で洗い出し操作を行う。
注記2 このウイルス懸濁液を,対照試料試験片の接種直後のウイルス洗い出し原液とする。
11.5 作用後のウイルスの洗い出し
11.3の作用後,抗ウイルス繊維製品試料の三つの試験片及び標準布試料の三つの試験片の入ったバイア
ル瓶(7.20)に,SCDLP培地(9.15)20 mLを加える。その後,キャップを締め,ボルテックスミキサー
(7.10)によって,5秒間を5回繰り返してかくはんし,各試験片からウイルスを洗い出す。
注記1 10.6の対照試験において,洗い出し液の組成を修正,変更するか,又は洗い出し液の増量を
行った場合には,それと同じ条件で洗い出し操作を行う。
注記2 これらのウイルス懸濁液を,抗ウイルス試料及び対照試料の作用後のウイルス洗い出し原液
とする。試験ウイルス懸濁液の濃度が108(PFU/mL又はTCID50/mL)の場合は,ウイルス懸
濁液の濃度は1×106(PFU/mL又はTCID50/mL)となる。なぜなら,洗い出し原液には0.2 mL
の試験ウイルス懸濁液が入っている。それをSCDLP培地(9.15)20 mLで希釈するため,0.2
/20=0.01=1×10−2,したがって,ウイルス懸濁液の濃度は,108×1×10−2=1×106となる。
12 ウイルス洗い出し液の希釈系列の作製
12.1 試験管に維持培地(9.8)1.8 mLを入れ,低温に保つ。
12.2 12.1の試験管に11.4及び11.5の洗い出し液0.2 mLを入れ,ボルテックスミキサー(7.10)によって
十分にかくはんする。
注記 これが1/10(10−1)希釈液となる。この希釈系列におけるウイルス懸濁液の濃度は,1×106×
10−1=1×105(PFU/mL又はTCID50/mL)となる。
12.3 新しい試験管に維持培地(9.8)1.8 mLを入れ,低温に保つ。
12.4 12.2のウイルス懸濁液0.2 mLを,12.3の試験管に入れて十分にかくはんする。
注記 これが1/100(10−2)希釈液となる。この希釈系列におけるウイルス懸濁液の濃度は,1×105
×10−1=1×104(PFU/mL又はTCID50/mL)となる。
12.5 ウイルス懸濁液の希釈系列を作製するために,12.1〜12.4の手順を繰り返す。
注記1 TCID50測定法の場合は,ウイルス懸濁液の希釈系列は,8穴(ウェル)全てが感染する希釈
点,及び8穴(ウェル)全てが感染しない希釈点を準備する必要がある。ただし,洗い出し
原液において8穴(ウェル)全てに感染が確認されない場合,一段階前の希釈系列は8穴(ウ
16
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ェル)全てが感染したと仮定して計算し,得られた結果には不等号を付ける。
注記2 試験ウイルス懸濁液の濃度が108TCID50/mLの場合は,0.2 mLの試験ウイルス懸濁液は20 mL
の洗い出し液によって希釈する。その結果,洗い出しウイルス懸濁液は,1×106 TCID50/mL
の濃度になる。そのため,TCID50測定法の場合は,1穴(ウェル)当たり0.1 mLのウイルス
懸濁液を接種するため,ウイルス懸濁液の希釈系列は10−6までが必要となる。
13 抗ウイルス感染価の測定
13.1 プラーク測定法
プラーク測定法による感染価の測定は,附属書Bによる。
13.2 TCID50測定法
TCID50測定法は,附属書Cによる。
14 抗ウイルス感染価の計算
14.1 プラーク測定法
プラーク測定法による感染価の計算は,次の式(1)及び式(2)による。
R
Z
P
×
=
················································································· (1)
ここに,
P: 感染価(PFU/0.1 mL)
Z: 2穴のプラーク数の平均値(個)
R: 希釈倍率
10
×
=P
W
················································································ (2)
ここに, W: 感染価(PFU/mL)
さらに,試験片の感染価(PFU/試験片)は,次の式による。
C
W
V
×
=
P
ここに, VP: 感染価(PFU/試験片)
C: 洗い出し液量(mL)
14.2 TCID50測定法
14.2.1 ベーレンス・ケルバー(Behrens and Karber)法
ベーレンス・ケルバー法による感染価の計算は,次の式(3)による。
5.0
10
−
∑
=
×
=
p
a
X
Y
a
············································································· (3)
ここに,
Y: 感染価(TCID50/0.1 mL)
X: 洗い出し原液の希釈倍率
p:
各希釈系列において細胞変性効果が認められる割合(細胞変
性効果ありの穴数/総穴数)

17
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
∑ p: 原液を含む各希釈系列のp値の総和
すなわち,感染価Aは,次の式による。
10
×
=Y
A
ここに,
A: 感染価(TCID50/mL)
さらに,試験片の感染価(TCID50/試験片)は,次の式による。
C
A
V
×
=
ここに,
V: 感染価(TCID50/試験片)
C: 洗い出しウイルス懸濁液の量
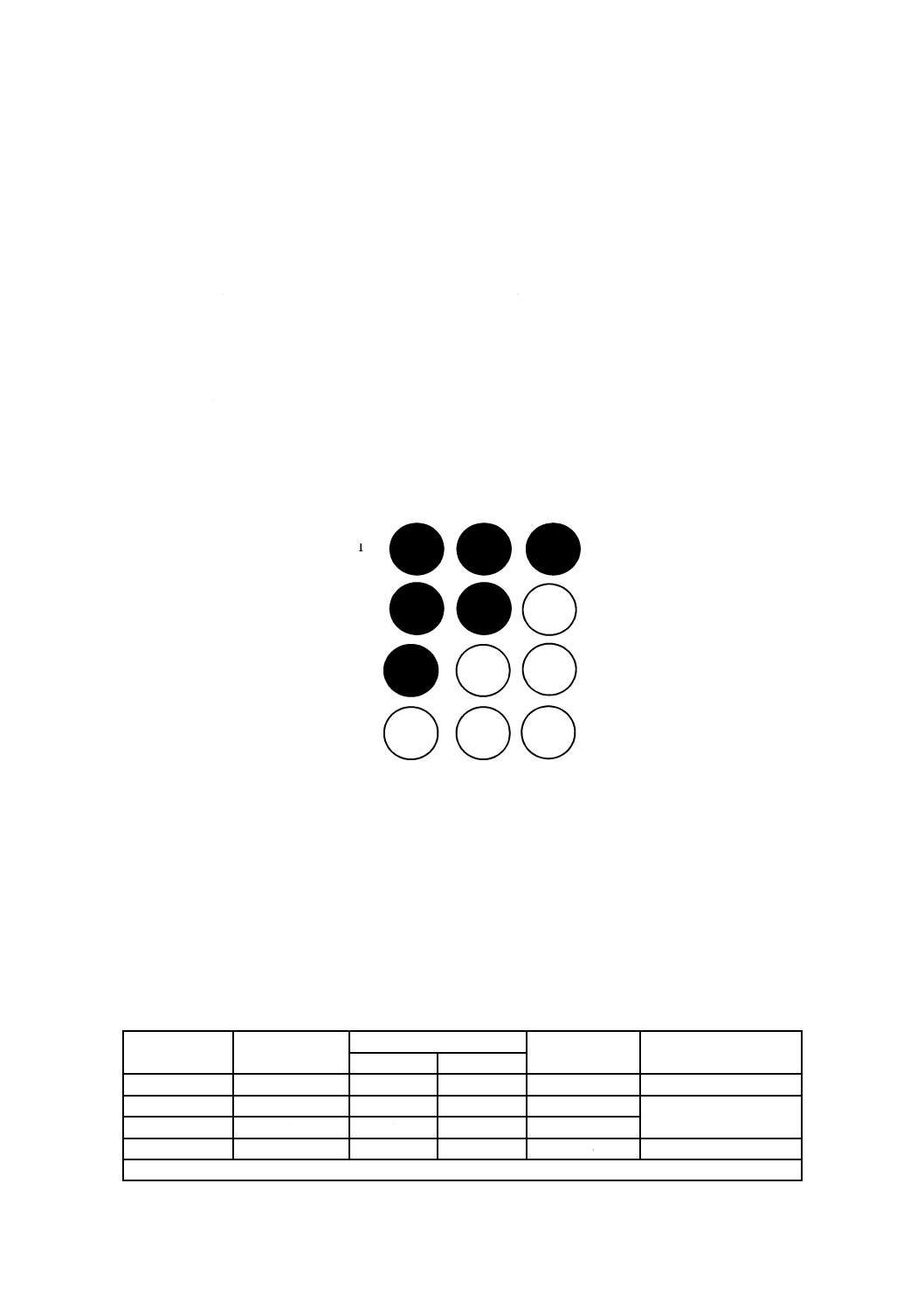
14.2.2 TCID50測定法の計算例
1
2
3
4
5
6
7
8
9
10
11
12
− 黒丸:細胞変性効果あり
− グレー丸:細胞変性効果なし
− 白丸:接種なし
1
洗い出し原液
2
1/10希釈(10倍希釈)
3
1/100希釈(100倍希釈)
4
1/1 000希釈(1 000倍希釈)
5
1/10 000希釈(10 000倍希釈)
図4−TCID50測定法の例
18
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図4の例による感染価の計算例は,次による。
X=100=1
∑ p=(8/8+7/8+4/8+1/8+0/8)=2.5
a=∑ p−0.5=2.5−0.5=2.0
よって,
Y=X×10a=1×102.0=1.0×102(TCID50/0.1 mL)
A=Y×10=1×103(TCID50/mL)
V=A×C=A×20=1×103×20=2.0×104(TCID50/試験片)
14.3 試験結果
14.3.1 試験成立の判定
次のいずれにも該当する場合に,試験が成立していると判定する。
a) 試験ウイルス懸濁液の感染価
− インフルエンザウイルス懸濁液濃度 >107 PFU/mL又はTCID50/mL
− ネコカリシウイルス懸濁液濃度 >107 PFU/mL又はTCID50/mL
b) 10.6によって,試験片の加工剤活性の抑制効果が確認されている。
c) 次の式(4)よって算出された対照試料の感染価の減少値を四捨五入によって小数点以下1桁に丸めたと
き,その値が 1.0 以下である。
)
(
)
(
)
(
b
a
b
a
log
log
/
log
V
V
V
V
M
−
=
=
·················································· (4)
ここに,
M: 対照試料の感染価の減少値
log(Va): 対照試料の試験ウイルス懸濁液接種直後の3検体の感染
価常用対数の平均値
log(Vb): 対照試料の2時間作用後の3検体の感染価常用対数の平
均値
注記 11.3の作用時間が24時間の場合は,対照試料の感染価の減少値は,2.0以下であることが望ま
しい。
14.3.2 抗ウイルス活性値の計算
次の式(5)によって抗ウイルス活性値を計算し,四捨五入法によって小数点以下1桁に丸める。
(
)
()
()
c
b
c
b
v
log
log
/
log
V
V
V
V
M
−
=
=
·················································· (5)
ここに,
Mv: 抗ウイルス活性値
log(Vb): 対照試料の2時間作用後の3検体の感染価常用対数の平
均値
log(Vc): 抗ウイルス試料の2時間作用後の3検体の感染価常用対
数の平均値
注記 Mが1.0未満,かつ,log(Va)がlog(Vb)を超える場合は,log(Vb)をlog(Va)に置き換えて計算して
もよい。
15 試験報告書
試験報告書には次の事項を記載する。
a) 規格番号
19
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
b) 試験試料の明細
c) 試験ウイルス株の明細
d) 試験結果
e) 規定から逸脱した内容

20
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A
(規定)
試験対象ウイルス株及び宿主細胞
A.1 試験対象ウイルス株及び宿主細胞
この規格で使用するウイルス株及び宿主細胞を,表A.1に示す。
表A.1−試験対象ウイルス株,宿主細胞及び増殖培地
対象
ウイルス
インフルエンザウイルス
ネコカリシウイルス
ウイルス株
Influenza A virus(H3N2): A/Hong
Kong/8/68: TC adapted
ATCC VR-1679
Influenza A virus (H1N1): A/PR/8/34:
TC adapted
ATCC VR-1469,
Feline calicivirus; Strain: F-9 ATCC
ATCC VR-782
宿主細胞a)
MDCK 細胞
(イヌ腎臓由来細胞)
ATCC CCL-34
CRFK 細胞
(ネコ腎臓由来細胞)
ATCC CCL-94
増殖培地b)
EMEM (9.7)
RPMI 1640 (9.7)
注a) 他の宿主細胞は,各ウイルスに対する感受性に関する適切な検証後に使用することができる。
b) 他の増殖培地は,細胞の増殖に関する適切な検証の後に使用することができる。

21
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B
(規定)
プラーク測定法
B.1
試験手順
B.1.1 10.3の6穴プラスチックプレートに,単層培養した細胞が均一に分布していることを倒立顕微鏡
(7.16)で確認した後,増殖培地を除去する。
B.1.2 維持培地(9.8)3 mLを加え,細胞表面を洗浄した後,余分な維持培地を除去する。この操作を2
回繰り返し,細胞表面を洗浄する。
B.1.3 洗い出し液の各希釈系列0.1 mLを1希釈系列当たり2穴ずつ,細胞表面に接種する。すなわち,
最初の2穴には洗い出し原液を接種し,次の2穴には1/10希釈ウイルス懸濁液を接種する。最後の列には,
細胞を検証するため,維持培地(9.8)0.1 mLを接種する。
B.1.4 B.1.3のプレートを表B.1の温度に設定されたCO2インキュベーター(7.24)に入れ,15分ごとに
プレートを揺すりながら,1時間保温し,ウイルスを細胞全体に吸着させる。
B.1.5 B.1.4のプレートに維持培地(9.8)3 mLを加え,表面を洗浄した後,余分な維持培地を除去する。
B.1.6 各穴にプラーク測定法用の寒天培地(9.14)3 mLを加え,蓋をして室温で約10分間静置する。
B.1.7 寒天培地が凝固したことを確認後,プレートを倒置し,表B.1の温度に設定されたCO2インキュベ
ーター(7.24)によって,2日〜3日間培養する。
培養後,CO2インキュベーター(7.24)からプレートを取り出し,元の向きに戻し,各穴に寒天上から,
細胞固定用ホルマリン溶液(9.4)3 mLを加え,室温で1時間以上静置し,細胞を固定する。
注記 細胞固定に関する適切な検証後,他の細胞固定液を使用することができる。
B.1.8 細胞固定後,B.1.7から寒天培地を除去し,各穴に細胞染色用メチレンブルー溶液(9.5)3 mLを加
え,室温で15分間以上静置し,細胞を染色する。
B.1.9 染色後の余分なメチレンブルー溶液を流水で洗い流し,細胞の染色を確認する(図B.1参照)。
B.1.10 プラーク(白い斑点)数を測定する。
B.1.11 2穴のプラーク数の平均値を算出する。
図B.1−プラーク測定法の写真例
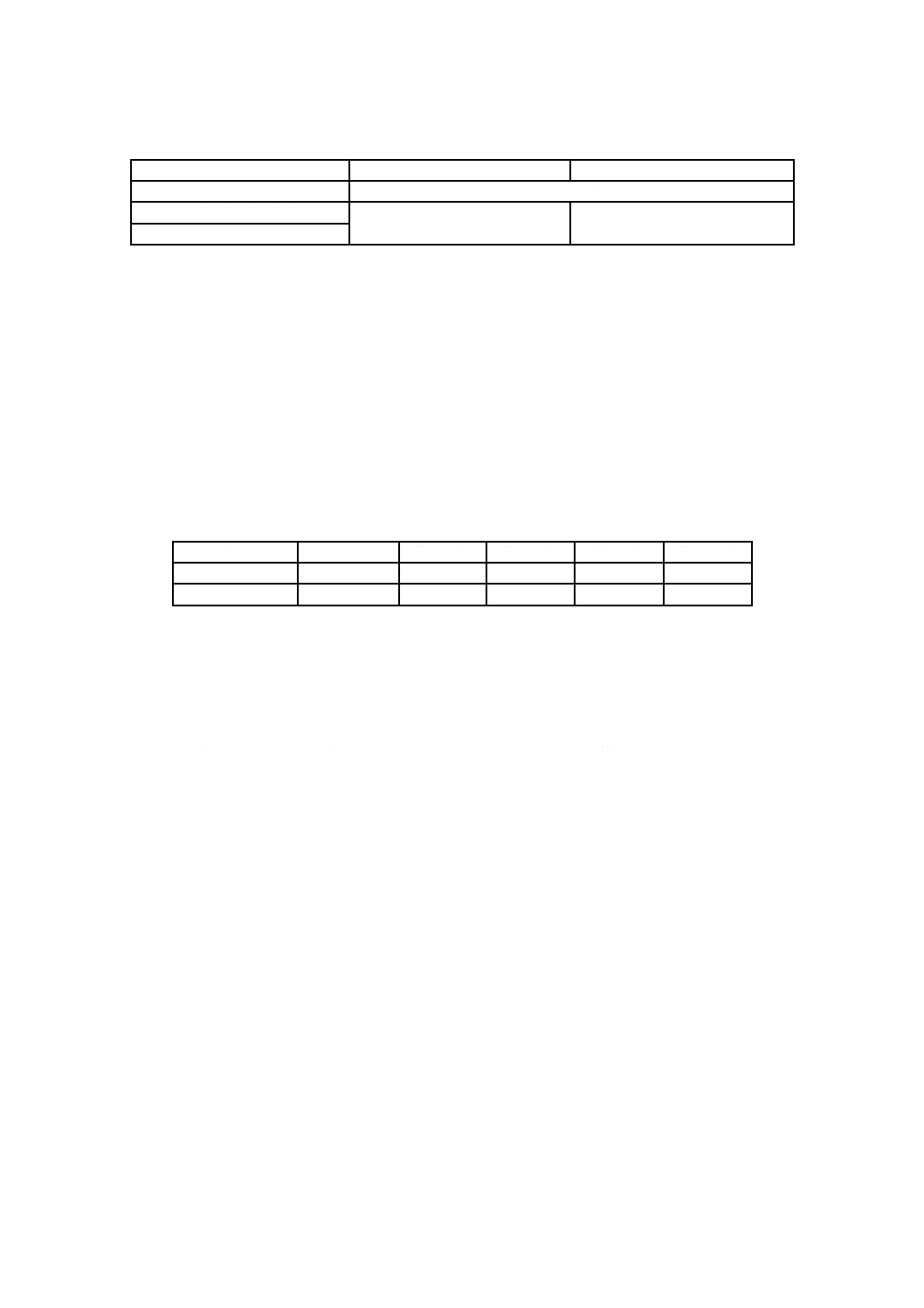
22
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表B.1−CO2インキュベーターの設定条件
試験対象ウイルス
インフルエンザウイルス
ネコカリシウイルス
規定箇条番号
10.4.4.2.1及び13.1
吸着温度設定(℃)
34
37
培養温度設定(℃)
B.2
プラーク数(PFU)の測定
B.2.1 概要
プラーク(白い斑点)は,60個程度まで数えることができる。60個以上になるとプラーク(白い斑点)
の分離が不明確になる。また,別のケースとして,プラークが確認されない場合がある。その場合は,2
穴の平均が1以下になることがある。そのため,プラーク数(PFU)の決定は,B.2.2による。
B.2.2 プラーク数(PFU)の決定
この規格に規定しているように,プラークは希釈系列の染色された細胞上の斑点として数えられる。プ
ラーク数は,表B.2の規定によってそれぞれの希釈倍率での二つのデータの平均として得られる。
表B.2−データの解釈
希釈系列
洗い出し原液
第1希釈
第2希釈
第3希釈
第N希釈
希釈倍率
1
10倍
100倍
1 000倍
10N倍
平均プラーク数
C1
C2
C3
C4
CN
プラーク数は,次のように決定する。
− C1からCNの一つの系列で,6〜60のプラーク数が得られた場合は,その値をその試験のプラーク数
(PFU)とする。
− C1が6以下の場合は,C1をその試験のプラーク数(PFU)とする。
− C1が0を含めて1以下の場合は,プラーク数(PFU)を1として計算する。
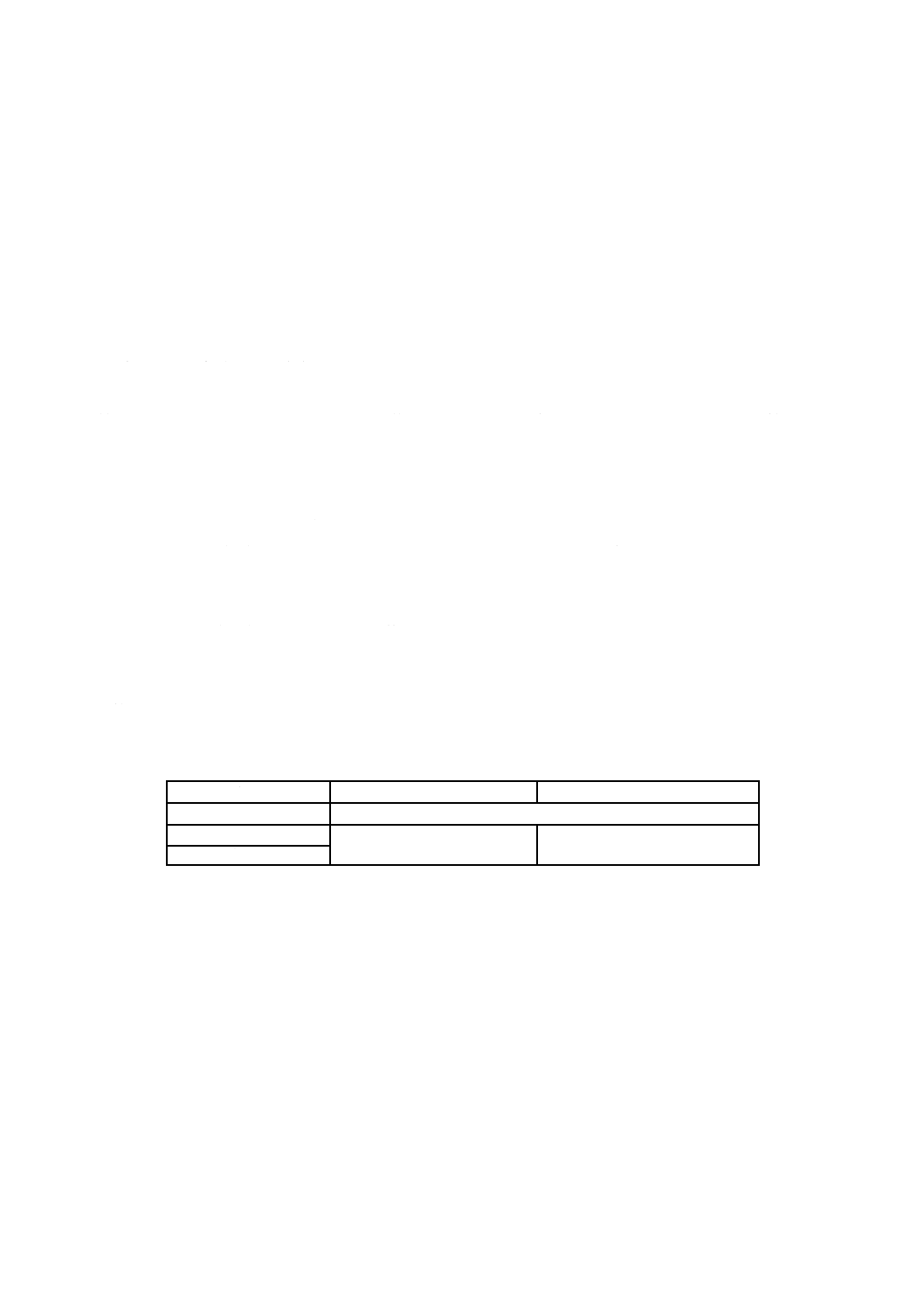
23
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C
(規定)
TCID50測定法
C.1 試験手順
C.1.1 10.3の96穴マイクロプレートに,単層培養した細胞が均一に分布していることを倒立顕微鏡(7.16)
で確認した後,増殖培地を除去する。
C.1.2 維持培地(9.8)0.1 mLを加え,細胞表面を洗浄した後,余分な維持培地を除去する。この操作を
2回繰り返し,細胞表面を洗浄する。
C.1.3 洗い出し液の各希釈系列0.1 mLを1希釈系列当たり8穴ずつ,細胞表面に接種する。すなわち,
最初の列の8穴に洗い出し原液を接種し,第2の列には1/10希釈のウイルス懸濁液を接種する。最後の列
には,細胞の検証のため維持培地(9.8)0.1 mLを接種する。
C.1.4 C.1.3の96穴マイクロプレートを表C.1の温度に設定されたCO2インキュベーター(7.24)に入れ,
1時間保温し,ウイルスを細胞に吸着させる。
C.1.5 プレートから上澄みを除去する。
C.1.6 維持培地(9.8)0.1 mLを加えて表面を洗浄後,余分な維持培地を除去する。
C.1.7 ネコカリシウイルスの場合は,維持培地(9.8)0.2 mLを加える。インフルエンザウイルスの場合
は,維持培地(9.16)0.2 mLを加える。その後,96穴マイクロプレートを表C.1の温度に設定したCO2イ
ンキュベーター(7.24)に入れ,7日間培養する。
C.1.8 倒立顕微鏡(7.16)によってそれぞれの穴の細胞変性効果を確認する。
C.1.9 細胞変性効果を確認後,ベーレンス・ケルバー(Behrens and Karber)法によってウイルスの感染価
を算出する。
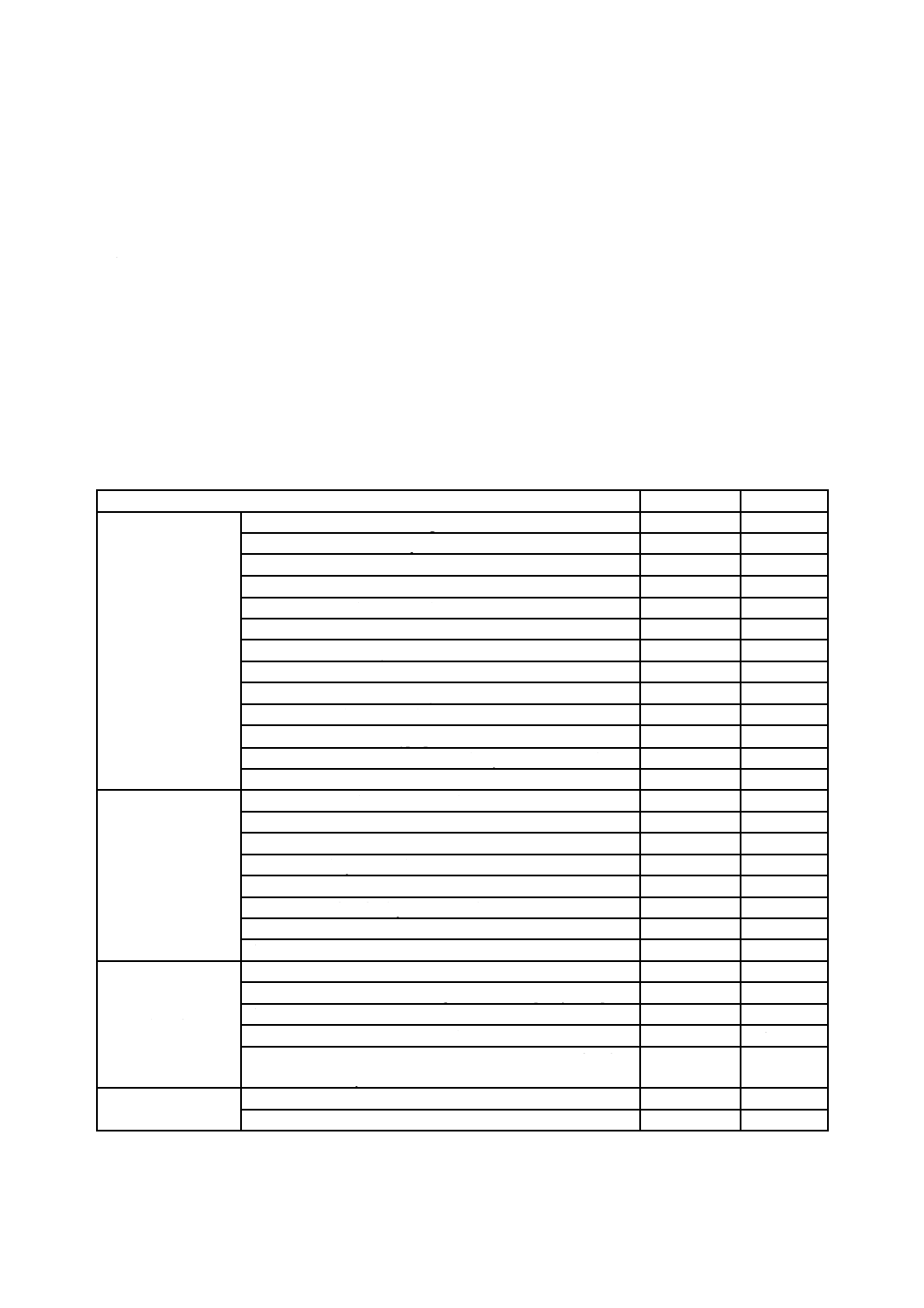
表C.1−CO2インキュベーターの設定条件
試験対象ウイルス
インフルエンザウイルス
ネコカリシウイルス
規定箇条番号
10.4.4.2.2及び13.2
吸着温度設定(℃)
34
37
培養温度設定(℃)
24
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書D
(規定)
培地の組成
D.1 概要
培地は市場で入手可能であり,細胞培養に使用する。期待する細胞増殖が観察される場合は,他の培地
も使用できる。
D.2 EMEM培地の組成
EMEM培地の組成を,表D.1に示す。EMEM培地は,市販品を利用することができる。不足する成分が
ある場合は,表D.1によって追加する。
表D.1−EMEM培地の組成
水1 000 mL中の組成
CAS No.
mg
アミノ酸
L-アルギニン一塩酸塩(L-Arginine HCl)
1119-34-2
126.40
L-シスチン二塩酸塩(L-Cystine 2HCl)
30925-07-6
31.20
L-グルタミン(L-Glutamine)
56-85-9
292.00
L-ヒスチジン塩酸塩一水和物(L-Histidine HCl H2O)
7048-02-4
41.90
L-イソロイシン(L-Isoleucine)
73-32-5
52.50
L-ロイシン(L-Leucine)
61-90-5
52.50
L-リジン塩酸塩(L-Lysine HCl)
657-27-2
72.50
L-メチオニン(L-Methionine)
63-68-3
15.00
L-フェニルアラニン(L-Phenylalanine)
63-91-2
32.50
L-トレオニン(L-Threonine)
72-19-5
47.60
L-トリプトファン(L-Tryptophan)
73-22-3
10.00
L-チロシン二ナトリウム二水和物(L-Tyrosine 2Na 2H2O)
122666-87-9
51.90
L-バリン(L-Valine)
72-18-4
46.80
ビタミン
コリンクロリド(Choline Chloride)
67-48-1
1.00
パントテン酸カルシウム(D Calcium Pantothenate)
137-08-6
1.00
葉酸水和物(Folic Acid)
59-30-3
1.00
イノシット(Myo Inositol)
87-89-8
2.00
ニコチン酸アミド(Nicotinamide)
98-92-0
1.00
ピリドキシン塩酸塩(Pyridoxine HCl)
58-56-0
1.00
リボフラビン(Riboflavin)
83-88-5
0.10
塩酸チアミン(Thiamine HCl)
67-03-8
1.00
無機塩
塩化カルシウム(Calcium Chloride)
10043-52-4
200.00
硫酸マグネシウム(無水)(Magnesium Sulfate[Anhydrous])
7487-88-9
97.70
塩化カリウム(Potassium Chloride)
7447-40-7
400.00
塩化ナトリウム(Sodium Chloride)
7647-14-5
6 800.00
りん酸二水素ナトリウム一水和物(Sodium Phosphate
Monobasic Monohydrate)
10049-21-5
140.00
その他
D-グルコース(D-Glucose)
50-99-7
1 000.00
フェノールレッドナトリウム(Phenol Red Sodium Salt)
34487-61-1
10.00

25
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
D.3 RPMI 1640 培地の組成
RPMI 1640培地は,市場で入手できる。その成分例を,表D.2に示す。
表D.2−RPMI 1640培地の組成
水1 000 mL中の組成
CAS No.
mg
アミノ酸
L-アルギニン(L-Arginine[Free Base])
74-79-3
200.00
L-アスパラギン(無水)(L-Asparagine[Anhydrous])
70-47-3
50.00
L-アスパラギン酸(L-Aspartic Acid)
56-84-8
20.00
L-シスチン二塩酸塩(L-Cystine 2HCl)
30925-07-6
65.20
L-グルタミン酸(L-Glutamic Acid)
56-86-0
20.00
L-グルタミン(L-Glutamine)
56-85-9
300.00
グリシン(Glycine)
56-40-6
10.00
L-ヒスチジン(L-Histidine[Free Base])
71-00-1
15.00
L-ヒドロキシプロリン(Hydroxy-L-Proline)
51-35-4
20.00
L-イソロイシン(L-Isoleucine)
73-32-5
50.00
L-ロイシン(L-Leucine)
61-90-5
50.00
L-リジン塩酸塩(L-Lysine HCl)
657-27-2
40.00
L-メチオニン(L-Methionine)
63-68-3
15.00
L-フェニルアラニン(L-Phenylalanine)
63-91-2
15.00
L-プロリン(L-Proline)
147-85-3
20.00
L-セリン(L-Serine)
56-45-1
30.00
L-トレオニン(L-Threonine)
72-19-5
20.00
L-トリプトファン(L-Tryptophan)
73-22-3
5.00
L-チロシン二ナトリウム二水和物(L-Tyrosine 2Na 2H2O)
122666-87-9
28.83
L-バリン(L-Valine)
72-18-4
20.00
ビタミン
ビオチン(Biotin)
58-85-5
0.20
コリンクロリド(Choline Chloride)
67-48-1
3.00
葉酸水和物(Folic Acid)
59-30-3
1.00
イノシット(Myo Inositol)
87-89-8
35.00
ニコチン酸アミド(Nicotinamide)
98-92-0
1.00
パントテン酸カルシウム(D Calcium Pantothenate)
137-08-6
0.25
p-アミノ安息香酸(p-Aminobenzoic Acid)
150-13-0
1.00
ピリドキシン塩酸塩(Pyridoxine HCl)
58-56-0
1.00
リボフラビン(Riboflavin)
83-88-5
0.20
塩酸チアミン(Thiamine HCl)
67-03-8
1.00
ビタミンB12(Vitamin B12)
68-19-9
0.005
無機塩
二硝酸カルシウム四水和物(Calcium Nitrate 4H2O)
13477-34-4
100.00
硫酸マグネシウム(無水)(Magnesium Sulfate[Anhydrous])
7487-88-9
48.84
塩化カリウム(Potassium Chloride)
7447-40-7
400.00
塩化ナトリウム(Sodium Chloride)
7647-14-5
6 000.00
りん酸ナトリウム(無水)(Sodium Phosphate
Dibasic[Anhydrous])
7558-79-4
800.00
その他
D-グルコース(D-Glucose)
50-99-7
2 000.00
グルタチオン(還元型)(Glutathione, Reduced)
70-18-8
1.00
フェノールレッドナトリウム(Phenol Red Sodium Salt)
34487-61-1
5.30

26
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書E
(参考)
ポリオウイルス
E.1
概要
ポリオウイルスは,化学物質に対する高い耐性をもち,酸に対して安定性があり,また,エーテルのよ
うな有機溶媒,界面活性剤及び4級塩による影響を受けないため,試験ウイルスとして選択される。
ポリオウイルスは,インフルエンザ及びネコカリシよりも小さなウイルスである。
この規格では,エンベロープウイルスであるインフルエンザ及び非エンベロープであるネコカリシの二
つのウイルスを選択している。しかし,非エンベロープのポリオウイルスが,並行して試験に用いられて
いる。この附属書は,このポリオウイルスのための情報及び試験方法について記載する。
E.2
ポリオウイルス株及び宿主細胞
ポリオウイルス株及び宿主細胞を,表E.1に示す。
表E.1−ポリオウイルス株及び宿主細胞
ウイルスの種類
ポリオウイルス
ウイルス株
Poliovirus type1 LSc-2ab
(WHO標準に準拠した経口生ポリオワクチン)
宿主細胞
HEp-2 cell
(ヒト咽頭がん細胞起源)
ATCC CCL-23
培地
EMEM(9.8.1)
E.3
試験条件
この試験のための全ての条件は,ネコカリシウイルスの場合と同様である。
27
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書F
(参考)
発育鶏卵を使用したウイルス感染価測定方法
F.1
概要
ウイルス感染価測定方法として発育鶏卵を使用する方法がある。この方法は,特にウイルスの感染によ
る疾病用ワクチン製造に使用されている。この規格に記載しているように,発育鶏卵のような生体を使用
しない培養細胞を使用する方法が一般的である。しかし,この発育鶏卵法は,ワクチン製造では幾つかの
試験機関で使用されている方法であるため,この附属書に参考として記載する。
F.2
適用範囲
この附属書は,繊維製品用のSPF発育鶏卵を用いるウイルス感染価の測定方法について記載する。
F.3
用語及び定義
F.3.1
SPF発育鶏卵(SPF embryonated hen's eggs)
ワクチン製造用に使用する病原性微生物に感染した経験のない鶏卵をいい,この附属書の測定で使用す
る。SPFは,特定病原体フリー(specfic pathogen free)に由来する。
F.4
試料の準備
F.4.1
試料から試験片を0.2 g採取する。試験片の数は3とする。
F.4.2
試料が織物,編物,不織布などのシート状のものの場合は,0.2 gを採取し,15 mm角に切りそろ
えて重ねる。
F.4.3
ポリエチレン製のチャック付き袋に入れる。
注記 試験前にオートクレーブなどによる試料の滅菌は,実施しない。
F.5
発育鶏卵の準備
10日齢のSPF発育鶏卵を準備する。
F.6
試験ウイルスの準備
インフルエンザウイルスは,ニワトリ胚適合株A/PR/8/34(H1N1),A/Aichi/3/68(H3N2)を使用する。
F.6.1
ウイルスの培養
F.6.1.1
ウイルス液の0.2 mLを,F.5の発育鶏卵のしょう(漿)尿膜腔内に接種する。
F.6.1.2
接種後,35 ℃の温度に設定されたインキュベーター(7.25)で3日間培養を行う。
F.6.1.3
その後,鶏卵を冷蔵庫で一晩冷却後に,しょう(漿)尿液を採取する。
F.6.1.4
採取したしょう(漿)尿液について,インフルエンザウイルスの増殖確認の検査を行う。感染し
た場合は,凝集が観察される。感染を確認後,その尿液をウイルス液又はウイルス培地とみなす。
F.6.1.5
試験を実施する直前に,ウイルス液を約107 EID50 / 0.2 mLのウイルス濃度になるように,pH 7.2
のりん酸緩衝生理食塩水(以下,PBSという。)で調製する。
28
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
F.6.2
0.5 % ニワトリ赤血球の準備
F.6.2.1
2 %くえん酸ソーダ1.0 mLを入れた注射器によって,鶏卵中のニワトリから静脈血4.0 mLを採取
し,それを試験管に入れる。
F.6.2.2
試験管を遠心分離機に設置し,1 000 gで10分間遠心分離する。
F.6.2.3
上澄みを捨て,その試験管にPBS 5 mLを加える。
F.6.2.4
F.6.2.2及びF.6.2.3を更に2回繰り返す。
F.6.2.5
試験管に沈殿したニワトリの赤血球0.5 mL及びPBS 99.5 mLを混合して,十分にかくはんする。
F.7
試験方法
F.7.1
概要
図F.1に試験の手順を示す。
試験手順
1
ウォーターバスを4 ℃に設定する。
2
プラスチックバックの中の試料
3
ウイルス液の入ったプラスチックバック
4
反応後回収したウイルス液
5
PBSで希釈したウイルス液の希釈系列
6
鶏卵へのウイルス液の接種
7
接種した鶏卵
図F.1−発育鶏卵法の通常の試験手順
注記 図F.1の4 ℃の温度に設定されたウォーターバスの代わりに25 ℃の試験室での試験も可能で
ある。
F.7.2
ウイルス液の試験片への接種
F.7.2.1
ポリエチレン製のチャック付き袋に試験片を入れる。
F.7.2.2
試験片の入ったポリエチレン袋にPBSで希釈したウイルス液を接種する。
F.7.2.3
反応時間として,そのポリエチレン袋を4 ℃の水浴中又は25 ℃の室温で,10分間又は2時間静
置する。
1
4
5
6
3
7
・・・
・・・
・
2
29
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
F.7.3
試験片に接種したウイルス液の10日齢発育鶏卵への接種
F.7.3.1
F.7.2.3のポリエチレン袋からウイルス液を取り出す。
F.7.3.2
この抽出ウイルス液をPBSによって,10−1,10−2,10−3,などのように10倍系列希釈する。
F.7.3.3
各系列につき3個ずつの10日齢発育鶏卵しょう(漿)尿膜腔内に,希釈液0.2 mLを接種する。
F.7.3.4
この希釈系列を接種した発育鶏卵を,35 ℃に設定したふ(孵)卵器で2日間培養する。
F.7.4
ウイルス試験
F.7.4.1
2日間培養後,しょう(漿)尿液を取り出し,試験管に入れる。
F.7.4.2
試験管に0.5 %ニワトリ赤血球浮遊液を加える。
F.7.4.3
試験管内のニワトリ赤血球の凝集の有無を観察する。ウイルス感染の判断は次による。
− ウイルス感染(−):赤血球が沈殿(凝集せず)。
− ウイルス感染(+):赤血球が凝集。
F.7.5
ウイルス感染価の算出
ウイルス感染価EID50は,リート・ミュンヒ(Read and Muench)法によって求める。50 %感染価EID50
は,各希釈率での累積感染数が50 %のところを求める。計算例を図F.2に示す。
1
希釈10−4のウイルス液接種
2
希釈10−5のウイルス液接種
3
希釈10−6のウイルス液接種
4
希釈10−7のウイルス液接種
黒丸:感染
白丸:非感染
図F.2−発育鶏卵法の例
図F.2の例での,EID50の計算例を表F.1に示す。
表F.1−EID50の計算例
希釈
感染鶏卵数
積算数
積算率
(%)
EID50
感染
非感染
10−4
3
6
0
100
10−5
2
3
1
75
比例計算
(75−50)/(75−25)
10−6
1
1
3
25
10−7
0
0
6
0
EID50=−5 −(75−50)/(75−25)=−5−0.5 =−5.5
1
2
3
4
30
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
F.8
抗ウイルス活性値
抗ウイルス活性値は,次の式によって算出する。
(
)
[
()
()]
aS
bS
aS
bS
vs
log
log
/
log
V
V
V
V
M
−
=
=
−
−
ここに,
Mvs: 抗ウイルス活性値
log(VaS): 試験片に接種されたウイルス液の反応時間終了後のウ
イルス感染価EID50
log(VbS): 試験片接種のために作製したウイルス液の静置時間終
了後のウイルス感染価EID50
仮に,VbSが10−7の場合は,
EID50=log10−7=−7 であり,
抗ウイルス活性値は,Mvs=−(−7)−5.5=1.5となる。

31
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書G
(参考)
抗ウイルス効果
G.1
抗ウイルス性能
抗ウイルス繊維製品は,この規格で得た結果によって,表G.1に記載する基準によって評価分類する。
表G.1−抗ウイルス効果の例
項目
抗ウイルス活性値Mvの基準値
効果の説明
抗ウイルス繊維製品
3 > Mv ≧2.0
効果あり
Mv≧3.0
十分な効果あり
32
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書H
(参考)
ラウンドロビン試験結果(1)
H.1 試験参加者
試験参加者は,1試験機関及び1研究機関である。
H.2 試料
7試料を試験した。試料の詳細を,表H.1に示す。
表H.1−ラウンドロビン試料の詳細
試料
番号
材質及び組成
抗ウイルス加工
注記
A
綿100 % 平織物
対照試料(加工なし)
A0:時間0,A2:2時間後
B
綿100 % ツイル織物
加工なし
−
C
通常加工
−
D
高濃度加工
−
E
ポリエステル65 %/
綿 35 %ブロード織物
加工なし
−
F
通常加工
−
G
高濃度加工
−
H.3 試験条件
試験条件は,次のとおりとする。
− 試験ウイルス:インフルエンザAウイルス(H1N1)又はインフルエンザAウイルス(H3N2)
− 宿主細胞:イヌ腎臓由来細胞(MDCK細胞)ATCC CCL-34
− 感染価測定法:プラーク測定法
H.4 試験結果
H.4.1 試験機関の試験結果
試験機関の試験結果を,表H.2に示す。
表H.2−試験機関の試験結果
試料番号
A0
A2
B
C
D
E
F
G
注記
作用時間(h)
0
2
2
2
2
2
2
2
−
log PFU/試験片
7.77
7.31
7.08
< 2.0
< 2.0
7.35
6.43
6.45
−
7.7
7.28
7.31
< 2.0
< 2.0
7.31
6.31
6.46
−
7.72
7.36
7.23
< 2.0
< 2.0
7.2
6.43
6.28
−
平均
7.73
7.32
7.21
< 2.0
< 2.0
7.29
6.39
6.40
−
感染価
log Va
log Vb
log Vc
−
対照試料の感
染価の減少値
(A0−A2)
0.41
≦2.0:OK
抗ウイルス活
性値
0.1
> 5.3
> 5.3
0.0
0.9
0.9
−

33
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
− 試験ウイルス:インフルエンザA ウイルス(H1N1)
試験ウイルス懸濁液の感染価は,検証しなければならない。
− インフルエンザウイルス懸濁液濃度は107 PFU/mLを超え,試験ウイルス懸濁液濃度は2.8×108
PFU/mLであった。
H.4.2 研究機関の試験結果
研究機関の試験結果を,表H.3に示す。
表H.3−研究機関の試験結果
試料番号
A0
A2
B
C
D
E
F
G
注記
作用時間(h)
0
2
2
2
2
2
2
2
−
log PFU/試験片
7.36
7.18
7.2
< 2.0
< 2.0
7.08
6.6
6.51
−
7.45
7.23
6.97
< 2.0
< 2.0
7.23
> 6
> 6
−
7.61
7.04
7.08
< 2.0
< 2.0
7.15
6.63
6.59
−
平均
7.47
7.15
7.08
< 2.0
< 2.0
7.15
6.62
6.55
−
感染価
log Va
log Vb
log Vc
−
対照試料の感
染価の減少値
(A0−A2)
0.32
≦2.0:OK
抗ウイルス活
性値
0.1
> 5.1
> 5.1
0.0
0.5
0.6
−
− 試験ウイルス:インフルエンザAウイルス(H3N2)
試験ウイルス懸濁液の感染価は,検証しなければならない。
− インフルエンザウイルス懸濁液濃度は107 PFU/mLを超え,試験ウイルス懸濁液濃度は1.8×108
PFU/mLであった。
34
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書I
(参考)
ラウンドロビン試験結果(2)
I.1
試験参加者
試験参加者は,4試験機関及び1研究機関である。
I.2
試料
7試料を試験した。試料の詳細を,表I.1に示す。
表I.1−ラウンドロビン試料の詳細
試料番号
材質及び組成
抗ウイルス加工
注記
綿100 % 織物
標準布試料
(加工なし)
A0:時間0,A2:2時間後
A
綿100 % 織物
加工あり
−
加工なし
−
B
綿100 % 織物
加工あり
−
加工なし
−
C
ポリプロピレン,ポリエチレン又は
レーヨン不織布
加工あり
−
加工なし
−
I.3
試験条件
試験条件は,次のとおりとする。
I.3.1
ウイルス及び宿主細胞
− 試験ウイルス:インフルエンザウイルス(H3N2)ATCC VR-1679
− 宿主細胞:イヌ腎臓由来細胞(MDCK細胞)ATCC CCL-34
− 感染価測定法:プラーク測定法
I.3.2
プラーク測定法条件
− 試験ウイルス懸濁液:0.3 %ウシ血清アルブミン添加
− 試験片質量:0.4 g
− ウイルス懸濁液の接種量:0.2 mL
− 作用条件:25 ℃,2時間
− 洗い出し液:SCDLP培地
I.4
試験結果
I.4.1
試料A
試料Aの試験結果を,表I.2に示す。
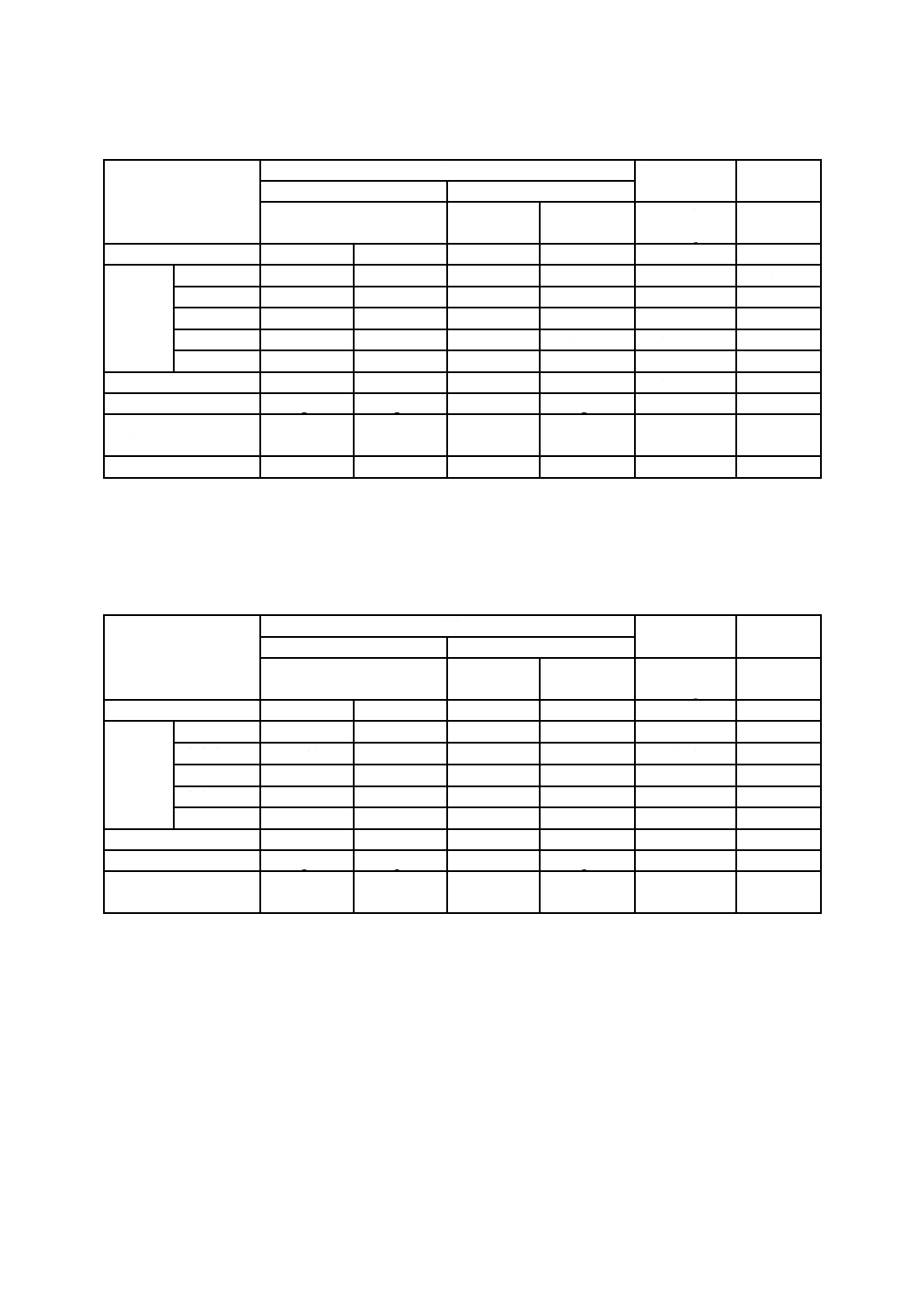
35
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表I.2−試料Aの試験結果
試料
抗ウイルス性
初期値
標準布試料
試料A
未加工
未加工
加工
Mv=log
Vb−log Vc
×108
作用時間(h)
0
2
2
2
log PFU/
試験片
試験機関1
7.41
6.71
6.74
3.56
3.2
1.5
試験機関2
7.01
6.84
6.76
< 2.0
> 4.84
0.47
試験機関3
7.13
6.48
6.09
< 2.0
> 4.48
0.65
試験機関4
7.72
7.38
7.33
< 2.0
> 5.4
3.5
研究機関
7.76
7.34
7.31
< 2.0
> 5.34
3.6
平均
7.47
7.01
6.91
−
> 4.65
感染価
log Va
log Vb
log Vc
対照試料の感染価の減
少値(A0−A2)
0.46
成立条件
≦2.0
≧107
I.4.2
試料B
試料Bの試験結果を,表I.3に示す。
表I.3−試料Bの試験結果
試料
抗ウイルス性
初期値
標準布試料
試料B
未加工
未加工
加工
Mv=log
Vb−log Vc
×108
作用時間(h)
0
2
2
2
log PFU/
試験片
試験機関1
7.41
6.71
6.89
6.42
0.3
1.5
試験機関2
7.01
6.84
6.93
6.25
0.59
0.47
試験機関3
7.13
6.48
6.35
5.91
0.57
0.65
試験機関4
7.72
7.38
7.30
6.54
0.8
3.5
研究機関
7.76
7.34
7.41
6.57
0.77
3.6
平均
7.47
7.01
7.04
6.40
0.6
感染価
log Va
log Vb
log Vc
対照試料の感染価の減
少値(A0−A2)
0.46
I.4.3
試料C
試料Cの試験結果を,表I.4に示す。
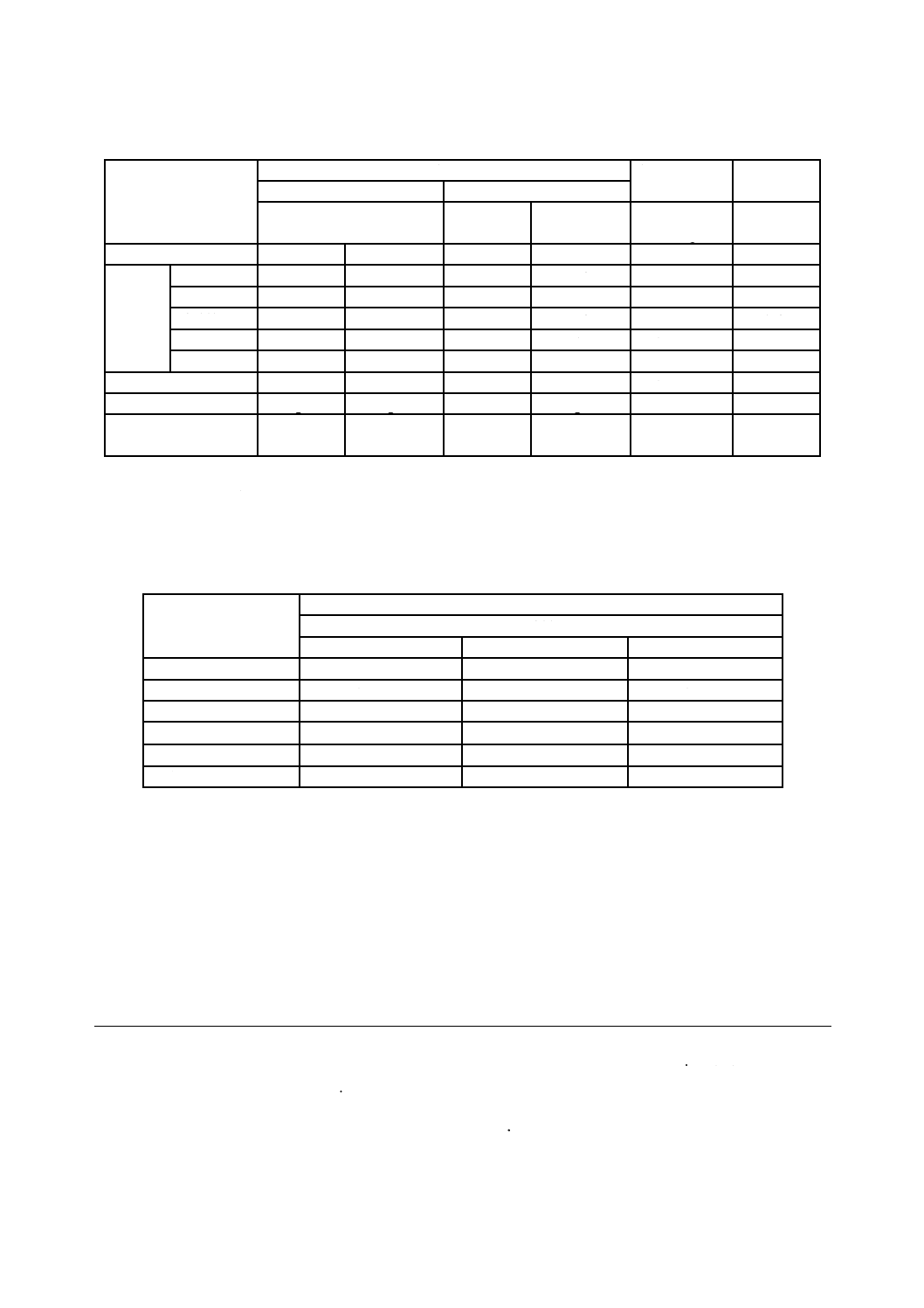
36
L 1922:2016
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
表I.4−試料Cの試験結果
試料
抗ウイルス性
初期値
対照試料
試料C
未加工
未加工
未加工
Mv=log
Vb−log Vc
×108
作用時間(h)
0
2
2
2
log PFU/
試験片
試験機関1
7.41
6.71
−
< 2
> 4.7
1.5
試験機関2
7.01
6.84
−
< 2
> 4.84
0.47
試験機関3
7.13
6.48
−
< 2
> 4.48
0.65
試験機関4
7.72
7.38
7.40
< 2
> 5.4
3.5
研究機関
7.76
7.34
7.70
< 2.56
> 4.78
3.6
平均
7.47
7.01
7.55
−
> 4.84
感染価
log Va
log Vb
log Vc
対照試料の感染価の
減少値(A0−A2)
0.46
I.4.4
ラウンドロビンテスト結果の集計
ラウンドロビンテスト結果の集計を,表I.5に示す。
表I.5−抗ウイルス試験結果のまとめ
試験機関及び研究所
抗ウイルス性
試料
A
B
C
試験機関1
3.2
0.3
> 4.7
試験機関2
> 4.84
0.59
> 4.84
試験機関3
> 4.48
0.57
> 4.48
試験機関4
> 5.4
0.8
> 5.4
研究機関
> 5.34
0.77
> 4.78
平均
> 4.65
0.6
> 4.84
参考文献
[1] EN 14476,Chemical disinfectants and antiseptics. Virucidal quantitative suspension test for chemical
disinfectants and antiseptics used in human medicine. Test method and requirements (phase 2, step 1)
[2] ISO 20743,Textiles−Determination of antibacterial activity of textile products
[3] JIS K 3800 バイオハザード対策用クラスIIキャビネット
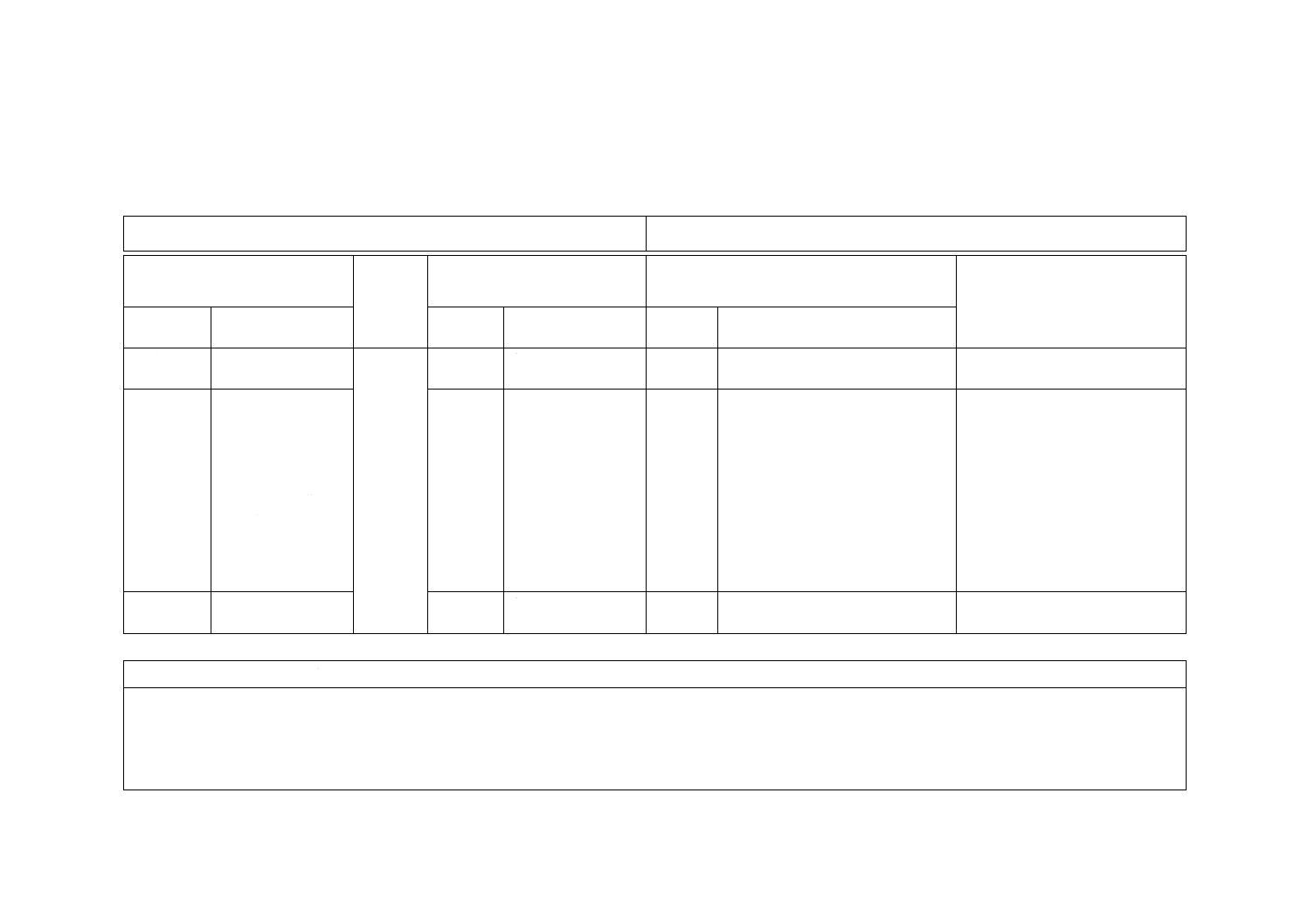
附属書JA
(参考)
JISと対応国際規格との対比表
JIS L 1922:2016 繊維製品の抗ウイルス性試験方法
ISO 18184:2014,Textiles−Determination of antiviral activity of textile products
(I)JISの規定
(II)国際
規格番号
(III)国際規格の規定
(IV)JISと国際規格との技術的差異の箇条ごと
の評価及びその内容
(V)JISと国際規格との技術的差
異の理由及び今後の対策
箇条番号
及び題名
内容
箇条番号
内容
箇条ごと
の評価
技術的差異の内容
3 用語及び
定義
JIS K 3600及びJIS
K 8008を規定
3
なし
追加
用語及び定義の引用規格を追加し
た。
我が国の実態に合わせて追加し
た。
9.1 水
ISO 3696に規定す
る3級のもの又は微
生物学用培地の作
製に使用できる分
析用品質のもので,
イオン交換,蒸留,
逆浸透,限外ろ過な
どを単独又はその
組合せによって精
製したもの。
9.1
ISO 3696に規定す
る3級のもの
変更
水の規定を変更した。
我が国の実態に合わせて変更し
た。
14.3.1 c),
14.3.2
数値の丸め方を規
定
14.3.1 c),
14.3.2
なし
追加
数値の丸めの方法を規定した。
ISOでは一般に規定しない。
JISと国際規格との対応の程度の全体評価:ISO 18184:2014,MOD
注記1 箇条ごとの評価欄の用語の意味は,次による。
− 追加 ················ 国際規格にない規定項目又は規定内容を追加している。
− 変更 ················ 国際規格の規定内容を変更している。
注記2 JISと国際規格との対応の程度の全体評価欄の記号の意味は,次による。
− MOD ··············· 国際規格を修正している。
3
7
L
1
9
2
2
:
2
0
1
6
2019年7月1日の法改正により名称が変わりました。まえがきを除き、本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。