K 3810-2:2003
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第14条によって準用する第12条第1項の規定に基づき,財団法人バイオイ
ンダストリー協会 (JBA)/財団法人日本規格協会 (JSA) から,工業標準原案を具して日本工業規格を改正
すべきとの申出があり,日本工業標準調査会の審議を経て,経済産業大臣が改正した日本工業規格である。
これによって,JIS K 3810-2 : 1997は改正され,この規格に置き換えられる。
JIS K 3810の規格群には,次に示す部編成がある。
JIS K 3810-1 第1部:培養による直接検出法
JIS K 3810-2 第2部:DNA蛍光染色による間接検出法
JIS K 3810-3 第3部:二段階PCRによる検出法
K 3810-2:2003
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
1. 適用範囲 ························································································································ 1
2. 引用規格 ························································································································ 1
3. 定義 ······························································································································ 1
4. 必要検出感度 ·················································································································· 1
5. 試験方法 ························································································································ 1
5.1 指標動物培養細胞 ·········································································································· 1
5.2 細胞培養用培地 ············································································································· 1
5.3 陽性対照マイコプラズマ ································································································· 2
5.4 試薬 ···························································································································· 2
5.5 装置及び器具 ················································································································ 2
5.6 操作 ···························································································································· 3
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 3810-2:2003
マイコプラズマの検出法−
第2部:DNA蛍光染色による間接検出法
Mycoplasma detection methods-
Part 2: Indirect DNA staining assay
1. 適用範囲 この規格は,マイコプラズマのDNAを蛍光染色することによって培養細胞中及び培養に
必要な試薬類に含まれるマイコプラズマを間接的に検出する方法について規定する。
2. 引用規格 次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成す
る。これらの引用規格は,その最新版(追補を含む。)を適用する。
JIS K 3600 バイオテクノロジー用語
JIS K 3604 組織培養用培地(最小必須培地)
JIS K 3605 高圧蒸気滅菌操作通則
3. 定義 この規格で用いる主な用語の定義は,JIS K 3600によるほか,次による。
a) 蒸留水 JIS K 3604の規定する純水。
b) マイコプラズマ 無細胞培地で発育可能な無細胞壁原核生物。DNAをゲノムとしてもつ。
c) コロニー形成単位 [Colony Forming Unit (CFU)] 寒天培地上で1個のコロニーを形成する試料1 ml
中のマイコプラズマの量。
d) DNA蛍光色素染色 4'-6-ジアミジノ-2-フェニルインドール・二塩酸(略称 DAPI)と同等の品質及
び染色性をもつ蛍光色素によって,DNAを特異的に蛍光染色すること。
参考 DAPIと同等の品質及び染色性をもつ蛍光色素には,ヘキストNo33258,No33217(アメリカン
ヘキスト)などがある。
e) ベロ細胞 (Vero細胞) アフリカミドリザルじん(腎)臓由来の細胞。
4. 必要検出感度 Mycoplasma hyorhinis又はMycoplasma argininiを100 CFU含む検体中のマイコプラズ
マを検出できること。
5. 試験方法
5.1
指標動物培養細胞 指標動物細胞は,ベロ細胞を用いる。
5.2
細胞培養用培地 細胞培養用培地(以下,MEM培地という。)は,JIS K 3604による。
2
K 3810-2:2003
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
5.3
陽性対照マイコプラズマ 陽性対照として用いるMycoplasma hyorhinis(ATCC 29052又はIFO 14858)
及びMycoplasma arginini(ATCC 23838又はIFO 14476)。ここで陰性対照には,蒸留水又はハンクス平衡塩
類溶液を用いる。
5.4
試薬
5.4.1
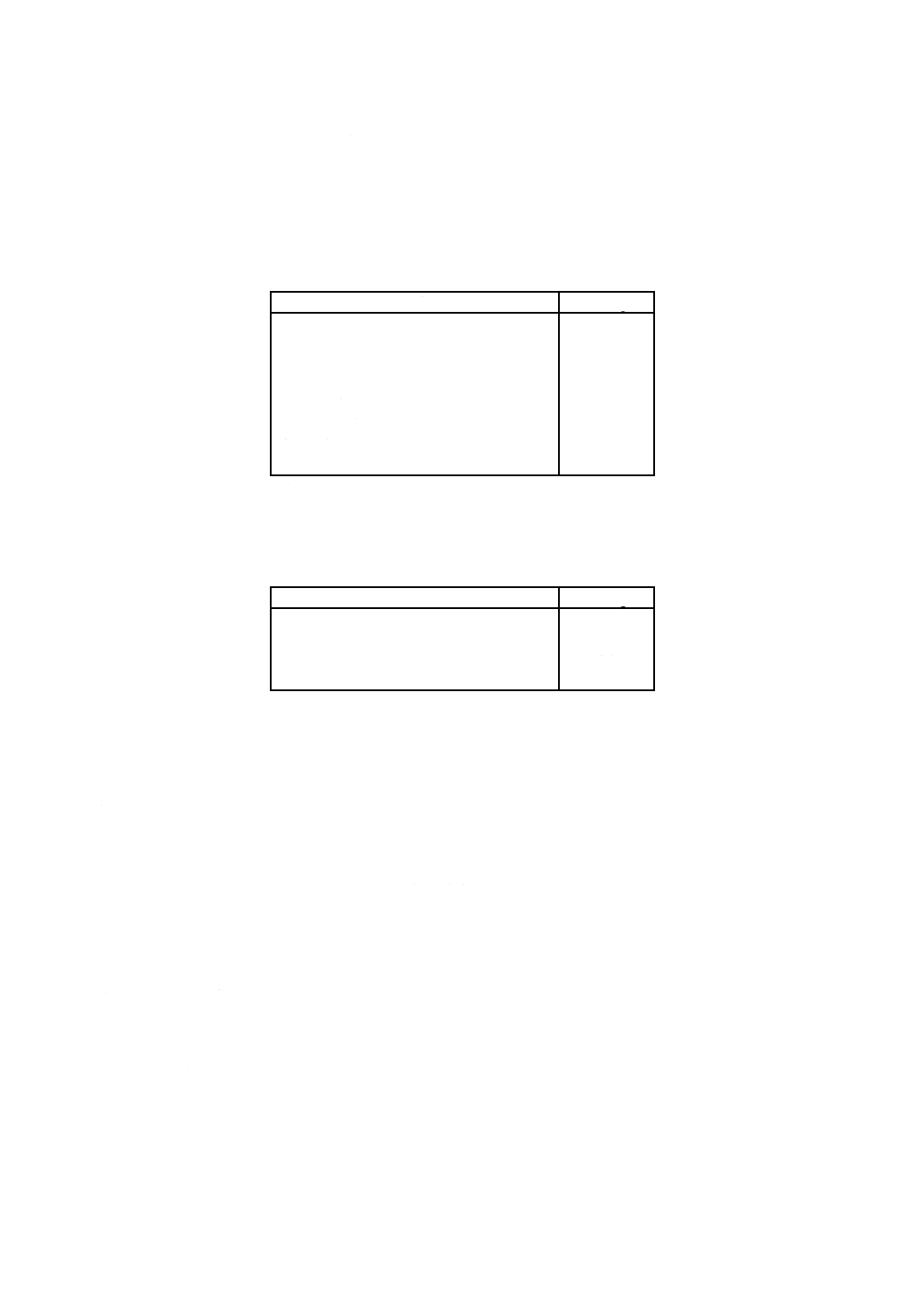
ハンクス平衡塩類溶液 ハンクス平衡塩類溶液(以下,HBSSという。)の組成を表1に示す。
表 1 ハンクス平衡塩類溶液
組成
添加量g/L
塩化ナトリウム
塩化カリウム
塩化カルシウム
硫酸マグネシウム
りん酸水素二ナトリウム二水和物
りん酸二水素カリウム
炭酸水素ナトリウム
D(+)グルコース
8.0
0.4
0.2
0.2
0.1
0.1
1.27
2.0
5.4.2
カルシウム及びマグネシウムを含まないダルベッコりん酸緩衝生理食塩水 カルシウム及びマグ
ネシウムを含まないダルベッコりん酸緩衝生理食塩水[以下,PBS(−)という。]の組成を表2に示す。
表 2 カルシウム及びマグネシウムを含まないダルベッコりん酸
緩衝生理食塩水
組成
添加量g/L
塩化ナトリウム
塩化カリウム
りん酸水素二ナトリウム
りん酸二水素カリウム
8.0
0.4
1.15
0.2
5.4.3
染色原液 4'-6-ジアミジノ-2-フェニルインドール・二塩酸5.0 mgを100 mlのHBSS又はPBS (−)
に溶かしたもの。室温で30〜40分間,スターラを用いてよくかき混ぜ,1 mlずつガラス瓶に分注し,完
全に遮光して,−20 ℃で保存する。
5.4.4
染色液 5.4.3染色原液をHBSS又はPBS(−)で希釈して0.1 μg/mlとする。染色液は使用時に調
製する。
5.4.5
マウント液 くえん酸 (0.1 mol/L) 22.2 mlとりん酸二ナトリウム (0.2 mol/L) 27.8 mlとをグリセリ
ン(第14改正日本薬局方)50 mlに溶かし,pH5.5に調節して,JIS K 3605に規定する高圧蒸気滅菌器で
加圧滅菌したもの。マウント液は,4 ℃で保存し随時用いる。
5.4.6
固定液 メタノールと酢酸とを容量比で3 : 1に混合したもの。使用時調製する。
5.5
装置及び器具
a) 細胞培養用プラスチックフラスコ(以下,培養フラスコという。) 25 cm2又は75 cm2のもの。
b) 細胞培養用プラスチック製シャーレ(以下,シャーレという。) 直径60 mm又は直径35 mmのもの。
c) マルチウエルプレート(以下,プレートという。) 1ウエルの直径が15.5 mmのもの。
d) 無蛍光スライドガラス
e) カバーガラス 40 mm×20 mm及び22 mm×27 mmの角形カバーガラス又は直径14 mmの丸形カバー
ガラス。
f)
スクレーパ
g) 遠心管
3
K 3810-2:2003
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
h) 蛍光顕微鏡 UV励起光を用い,400〜600倍で観察可能な落射型蛍光顕微鏡。
i)
倒立顕微鏡 約100倍で観察可能な倒立顕微鏡。
j)
二酸化炭素インキュベータ
k) 高圧蒸気滅菌器 JIS K 3605に規定するもの。
l)
遠心機 スイング型ロータを装着できるもの。
m) スターラ
5.6
操作
5.6.1
検体の調製
a) 検体 検体は,被験対象となる培養細胞,血清,培地,トリプシン溶液などとする。被験対象となる
培養細胞の場合は,抗生物質を含まないMEM培地を2回以上継代培養し,最後の継代後,培地交換
して,更に3日後の培養細胞を付着細胞の場合はスクレーパでか(掻)き取り,培地とともに採取す
る。140×g(実効回転半径12 cmの遠心機で1 000 rpm)で3分間遠心分離し,その上澄み液を検体と
して用いる。血清,培地,トリプシン溶液などは原液のまま用いる。
b) 最終試験検体の調製 ベロ細胞を25 cm2培養フラスコ又は75 cm2培養フラスコに培養し,細胞が培養
面の約8割を占めたとき,10 %ウシ胎児血清を含む新鮮なMEM培地と交換する。25 cm2培養フラス
コの場合は4 ml, 75 cm2培養フラスコの場合は20 mlの培地とする。
a) の検体を,フラスコの大きさに対応してそれぞれ1 ml又は5 mlを加え,4日間培養する。スク
レーパでベロ細胞をかき取り,培地とともに採取する。140×gで3分間遠心分離し,その上澄液を最
終試験検体として用いる。
5.6.2
検査培養 一つの最終試験検体につき,次の検査培養を2回以上行う。
a) 60 mmシャーレ,35 mmシャーレ,又はプレートにカバーガラス(それぞれ40 mm×20 mm,22 mm
×27 mmの角形,又は直径14 mmの丸形)を入れる。
b) 前培養のため,指標細胞の懸濁液[a) の大きさに対応し,それぞれ1×105/4 ml/60 mmシャーレ,2×
104/2 ml/35 mmシャーレ,5×103/1.5 ml/ウエル]を入れる。
c) 体積分率5 %二酸化炭素−体積分率95 %空気のガス環境下,37 ℃で1日間培養する。培地を除き,
新鮮な培地をそれぞれ4 ml,2 ml又は1.5 ml入れる。
d) 最終試験検体をとり,それぞれ,0.5 ml,0.5 ml,0.2 mlを接種する。
e) 滅菌した培地を陰性対照のシャーレ又はプレートに加える。
f)
陽性対照として,Mycoplasma hyorhinisを100 CFUを含む培地(それぞれ0.5 ml,0.5 ml及び0.2 ml)
を加える。さらに,Mycoplasma arginini(ATCC 23838又はIFO 14476)を100 CFU含む培地(それぞ
れ0.5 ml,0.5 ml,0.2 ml)を別のシャーレ又はプレートに加える。
g) 体積分率5 %二酸化炭素−体積分率95 %空気のガス環境下で,37 ℃で4日間培養する。
5.6.3
染色方法
a) 培養液を取り除く。
b) 固定液をシャーレの端から徐々に加え,ゆっくり全体に行き渡るようにする。このとき60 mmシャー
レには5 ml,35 mmシャーレ及びプレートの1ウエルには2 mlを用いる。
c) 5分後,固定液を取り除き,再度前項と同量の固定液を加え,10分間固定する。
d) 固定液を取り除き,風乾する。
e) 60 mmシャーレには5 ml,35 mmシャーレ及びプレートの1ウエルには2 mlの染色液を加え,30分
間染色する。
4
K 3810-2:2003
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
f)
蒸留水で3回洗浄する。
g) スライドガラスにマウント液を1,2滴落とす。一方,カバーガラスをシャーレ又はプレートから取り
出し,細胞面を下にしてスライドガラスのマウント液の上に置く。必要ならば,カバーガラスの端を
市販のラッカー又はエナメルで封入する。
5.6.4
蛍光顕微鏡観察 蛍光顕微鏡をUV励起光条件にし,倍率を400〜600倍の条件にする。5.6.5に規
定する判定基準に従って陽性又は陰性を判定する。判定が不確定となったものは,5.6.1から再度検査をや
り直す。記録保存のため必要があれば写真撮影を行う。
5.6.5
判定基準 マイコプラズマの陽性又は陰性の判定は,次による。
蛍光顕微鏡の接眼レンズ10倍用,対物レンズ40倍用又は60倍用にして,ランダムに10視野以上観察
する。陰性対照は,細胞核が大きなだ(楕)円形に光って見える。陽性対照は,指標細胞の核だけが大き
なだ円形に光って見え,その核を囲み汚染生物のDNAであることを示す小さな光る点が観察される。こ
の微小な核外蛍光はん(斑)点をもつ細胞が1 000個のうち5個 (0.5 %) 以上あれば陽性(+)とする。
これ以下ならば陰性(−)と判定する。微小な核外蛍光はん点数が少なくて,(+)か明らかな(−)か判
定しにくいときは,不確定(±)とする。
