K 3706-2:2008
(1)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
まえがき
この規格は,工業標準化法第12条第1項の規定に基づき,財団法人バイオインダストリー協会(JBA)及
び財団法人日本規格協会(JSA)から,工業標準原案を具して日本工業規格を制定すべきとの申出があり,日
本工業標準調査会の審議を経て,経済産業大臣が制定した日本工業規格である。
この規格は,著作権法で保護対象となっている著作物である。
この規格の一部が,特許権,出願公開後の特許出願,実用新案権又は出願公開後の実用新案登録出願に
抵触する可能性があることに注意を喚起する。経済産業大臣及び日本工業標準調査会は,このような特許
権,出願公開後の特許出願,実用新案権又は出願公開後の実用新案登録出願に係る確認について,責任は
もたない。
JIS K 3706の規格群には,次に示す部編成がある。
JIS K 3706-1 第1部:リステリア・モノサイトゲネスの検出
JIS K 3706-2 第2部:リステリア・モノサイトゲネスの生菌数測定
K 3706-2:2008
(2)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
目 次
ページ
序文 ··································································································································· 1
1. 適用範囲 ························································································································ 1
2. 引用規格 ························································································································ 2
3. 定義 ······························································································································ 2
4. 一般原則 ························································································································ 2
5. 培地及び試薬 ·················································································································· 3
6. 装置及びガラス器具 ········································································································· 3
6.1 乾熱滅菌器又は蒸気滅菌器······························································································· 3
6.2 乾燥キャビネット又は細菌培養器······················································································ 3
6.3 細菌培養器 ··················································································································· 3
6.4 恒温水槽 ······················································································································ 3
6.5 白金線及び白金耳 ·········································································································· 3
6.6 ガラス又はプラスチック製のスプレッダー(コンラージ棒) ·················································· 3
6.7 pHメータ ····················································································································· 3
6.8 試験管又はフラスコ ······································································································· 3
6.9 吹出し式(先端目盛)メスピペット ··················································································· 3
6.10 シャーレ ····················································································································· 3
6.11 ジャー(任意) ············································································································ 3
6.12 混合ガス(任意) ········································································································· 3
6.13 透過光線[透過光線試験(斜光法)]用の機器(任意) ························································ 3
6.14 顕微鏡 ························································································································ 3
7. サンプリング方法 ············································································································ 3
8. 試料の調製 ····················································································································· 3
9. 手順 ······························································································································ 3
9.1 試料,試料懸濁液及び希釈試料液······················································································ 3
9.2 接種及び培養 ················································································································ 4
9.3 典型的コロニーの生菌数測定···························································································· 4
9.4 リステリア属の確認 ······································································································· 4
9.5 リステリア・モノサイトゲネスの確認 ················································································ 5
9.6 形態学的・生理学的特性及び生化学反応による同定 ······························································ 7
9.7 最終確認 ······················································································································ 8
10. 試験結果の表現 ············································································································· 8
10.1 リステリア・モノサイトゲネスのコロニー数計測 ······························································· 8
10.2 算出方法 ····················································································································· 8
11. 精度 ···························································································································· 9
K 3706-2:2008 目次
(3)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
ページ
12. 培地の品質管理 ············································································································· 9
13. 試験報告書 ··················································································································· 9
附属書A(規定)手順の概略図 ······························································································ 10
附属書B(規定)培地・試薬の組成及び調製 ············································································· 11
附属書C(参考)透過光線試験(斜光法) ··············································································· 18
参考文献 ···························································································································· 19
附属書1(参考)JISと対応する国際規格との対比表 ·································································· 20
K 3706-2:2008
(4)
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
白 紙
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
日本工業規格 JIS
K 3706-2:2008
培地の試験方法−
リステリア・モノサイトゲネス用培地−
第2部:リステリア・モノサイトゲネスの
生菌数測定
Test methods for culture media-Culture medium for Listeria
monocytogenes-Part 2: Enumeration of Listeria monocytogenes
序文 この規格は,1998年に第1版として発行されたISO 11290-2,Microbiology of food and animal feeding
stuffs−Horizontal method for the detection and enumeration of Listeria monocytogenes−Part 2 : Enumeration
method及びAMENDMENT 1 (2004)を翻訳し,技術的内容を変更して作成した日本工業規格である。ただ
し,追補(AMENDMENT)については,編集し,一体とした。
なお,この規格で点線の下線を施してある箇所は,原国際規格を変更している事項である。変更の一覧
表をその説明を付けて,附属書1(参考)に示す。
1. 適用範囲 この規格は,培地を用いてリステリア・モノサイトゲネス(Listeria monocytogenes)の生
菌数を測定する方法について規定する。
この規格で用いる試料は,食品及び動物用飼料とする。
警告 検査員の健康を守るため,リステリア・モノサイトゲネス(Listeria monocytogenes)の検出試
験は,適切な設備が整っている検査室において熟練の微生物学専門家の管理下に行われること
及び汚染されたあらゆる物質の廃棄には細心の注意を払うことを強く推奨する。また,特に女
性検査員は,リステリア・モノサイトゲネスへの暴露による母体の感染が,発育中の胎児に対
して特に危険であるという点を認識することを強く推奨する。
備考1. この規格の方法は,食品・飼料試料の衛生的品質の指標として使用されることのある,他の
リステリア属についても生菌数を測定することができる。
2. この規格の方法で,測定できるリステリア・モノサイトゲネス数の下限値は,液体試料では
試料1 mL当たり10,他の試料では試料1 g当たり100である。
3. この規格の対応国際規格を,次に示す。
なお,対応の程度を表す記号は,ISO/IEC Guide 21に基づき,IDT(一致している),MOD
(修正している),NEQ(同等でない)とする。
ISO 11290-2:1998,Microbiology of food and animal feeding stuffs−Horizontal method for the
detection and enumeration of Listeria monocytogenes−Part 2: Enumeration method及び
AMENDMENT 1 (2004) (MOD)
2
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2. 引用規格 次に掲げる規格は,この規格に引用されることによって,この規格の規定の一部を構成す
る。これらの引用規格は,その最新版(追補を含む。)を適用する。
JIS K 3701 培地の試験方法−通則
備考 ISO 7218:1996 Microbiology of food and animal feeding stuffs−General rules for microbiological
examinations及びAMENDMENT 1:2001からの引用事項は,この規格の該当事項と同等であ
る。
JIS K 3702 培地の試験方法−試料懸濁液及び希釈系列の調製方法
備考 ISO 6887-1:1999 Microbiology of food and animal feeding stuffs−Preparation of test samples,
initial suspension and decimal dilutions for microbiological examination−Part 1: General rules for
the preparation of the initial suspension and decimal dilutionsからの引用事項は,この規格の該当
事項と同等である。
JIS K 3706-1 培地の試験方法−リステリア・モノサイトゲネス用培地−第1部:リステリア・モノ
サイトゲネスの検出
備考 ISO 11290-1:1996 Microbiology of food and animal feeding stuffs−Horizontal method for the
detection and enumeration of Listeria monocytogenes−Part 1: Detection method及び
AMENDMENT 1 (2004)からの引用事項は,この規格の該当事項と同等である。
JIS K 8008 生化学試薬通則
3. 定義 この規格で用いる主な用語の定義は,JIS K 3701,JIS K 3702,JIS K 3706-1及びJIS K 8008
によるほか,次による。
3.1
リステリア・モノサイトゲネス(Listeria monocytogenes) この規格で規定する試験で,選択分離培
地上に定形コロニーを形成し,特徴的な形態,生理及び生化学的性質を示す微生物。
3.2
リステリア・モノサイトゲネスの生菌数測定(enumeration of Listeria monocytogenes) この規格で
規定する試験で,所定の質量又は体積の試料中におけるリステリア・モノサイトゲネスの生菌数を測定す
ること。
3.3
精製水 JIS K 8008の3.2に規定するA2の水。
備考 これを超える精製度のものを使用することに関しては制限しない。滅菌水は,イオン交換水の
品質以上のものを乾熱滅菌若しくは蒸気滅菌又はフィルターでろ過し除菌したものとする。ま
た,市販の精製水を用いる場合は,この規格で規定する精製水と同等以上の品質のものとする。
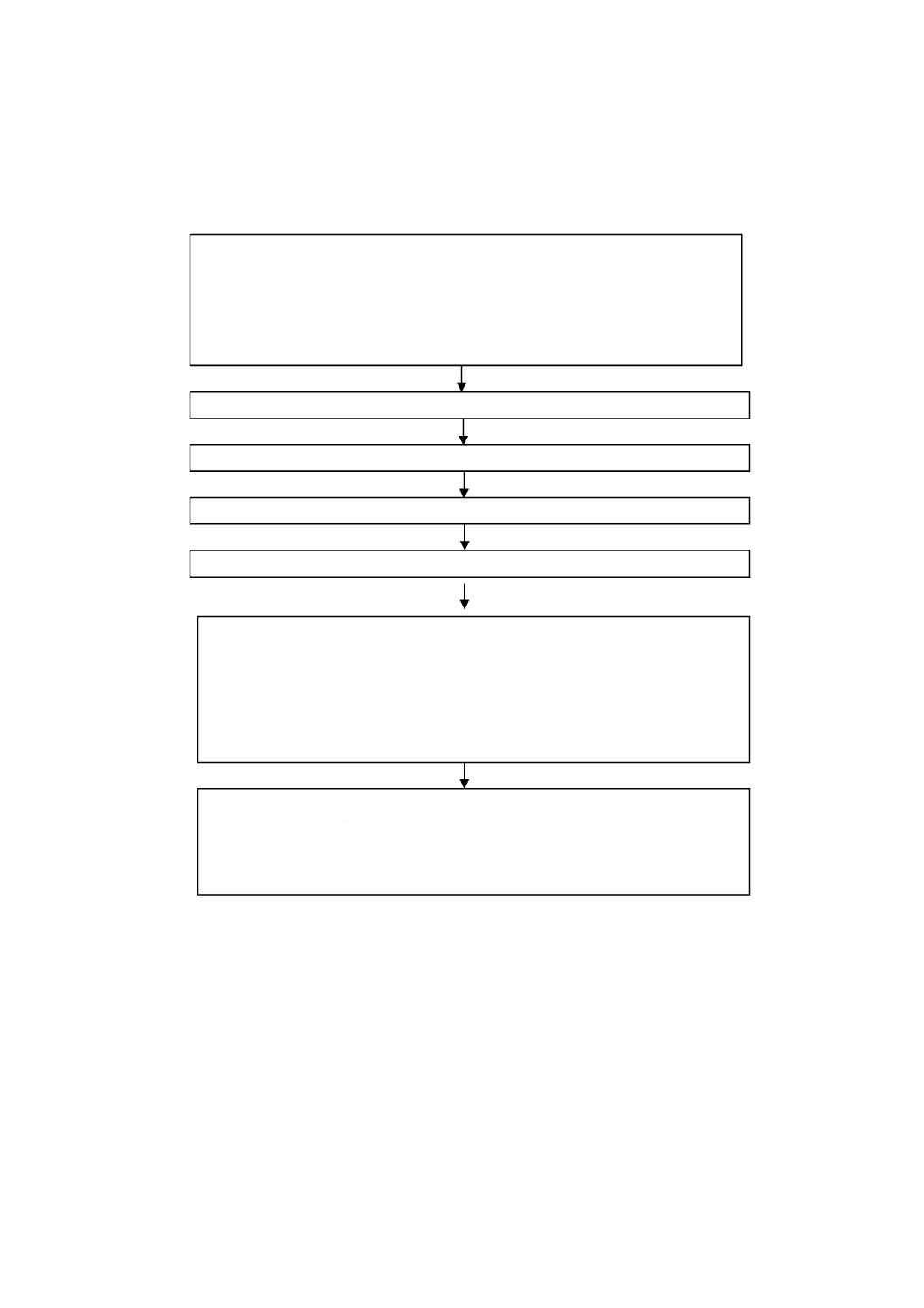
4. 一般原則 この規格を用いてリステリア・モノサイトゲネスの生菌数を測定するには,連続する6段
階の操作を必要とする(附属書A参照)。
4.1
必要に応じ,記載する二つの希釈液のうち一つを用いて試料懸濁液を調製する。
4.2
20 ℃で1時間,回復培養を行う。
4.3
シャーレに入った2枚の固形選択培地上に,液体試料の場合は規定量の試料を,他の試料の場合に
は規定量の試料懸濁液を塗抹する。同条件で,試料又は初期懸濁液の10倍段階希釈液を用いて他の平板を
作製する。
4.4
各平板を37 ℃で培養し,24時間後及び48時間後に検査を行う。
4.5
リステリア・モノサイトゲネスと推定されるコロニーについて,この規格に規定する試験によって
確認する。
3
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
4.6
確認されたコロニー数から,試料1 g又は1 mL当たりのリステリア・モノサイトゲネス生菌数を算
出する。
5. 培地及び試薬 JIS K 3701による。
備考 培地及び試薬の組成並びに調製法を,附属書Bに示す。
6. 装置及びガラス器具 通常の微生物検査用機器(JIS K 3701)及び次のものを用いる。
6.1
乾熱滅菌器又は蒸気滅菌器 JIS K 3701による。
6.2
乾燥キャビネット又は細菌培養器 25±1 ℃〜50±1 ℃を保持できるもの。
6.3
細菌培養器 接種した培地,平板及び試験管を,次の温度範囲内に保つもの。
a) 20±1 ℃(任意)
b) 25±1 ℃(任意)
c) 37±1 ℃
6.4
恒温水槽 44 ℃から47 ℃に保持できるもの。
6.5
白金線及び白金耳 白金・イリジウム合金若しくはニッケル・クロム合金製の線,又はパスツール
ピペット若しくは白金耳。
6.6
ガラス又はプラスチック製のスプレッダー(コンラージ棒) 滅菌済みのもの。
6.7
pHメータ 25 ℃における表示分解能が0.01 pHであり,±0.1 pHの精度で測定できるもの。
6.8
試験管又はフラスコ 培地の滅菌・保存,及び液体培地の培養に使用できる適切な容量のもの。
6.9
吹出し式(先端目盛)メスピペット 容量が1 mL及び10 mLで,それぞれ0.1 mL,0.5 mL単位で
目盛られているもの。
6.10 シャーレ 直径が90 mm及び140 mmのもの。
6.11 ジャー(任意) 微好気培養に適したもの。
6.12 混合ガス(任意) 微好気培養に使用する,規定の組成(CO2 5〜12 %,O2 5〜15 %,及びN2 100 %
まで)のもの。
6.13 透過光線[透過光線試験(斜光法)]用の機器(任意) 附属書Cによる。
6.14 顕微鏡 位相差によるもの。
7. サンプリング方法 この規格では規定しない。個別の規格に当該試料のサンプリング方法の規定がな
い場合は,受渡当事者間の協定による。
備考 検査対象を真に代表する試料が,輸送中又は保存中に,損傷又は変質することなく,検査室に
届けられることが重要である。
8. 試料の調製 当該試料を扱う個別の規格による。個別の規格がない場合は,受渡当事者間の協定によ
る。
9. 手順
9.1
試料,試料懸濁液及び希釈試料液 JIS K 3702参照。試料懸濁液の調製では,希釈液として,緩衝
ペプトン水(附属書B.1)又はhalf Fraserブロスの基礎培地(附属書B.2)のいずれかを使用する。
食品又は飼料が試料の場合,同一試料に対して検出法(JIS K 3706-1参照)及びこの規格の生菌数測定
4
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
方法の双方を実施するとき,選択剤を添加しないhalf Fraserブロスの基礎培地を希釈液として使用しても
よい。この手順は,最初に,二つの試料懸濁液を調製する手間をなくすためのものである。選択剤は,生
菌数測定用の試料分を使用した後で懸濁液に添加する。この手順を用いたことを試験報告書に記述するの
が望ましい。
試料懸濁液を20±2 ℃で1時間±5分間静置し〔必要であれば,細菌培養器 [6.3 a)]を使用する。〕,
ストレスを受けた微生物を回復させる。希釈系列を用いる場合は,この回復培養後に調製を行う。
9.2
接種及び培養
9.2.1
滅菌ピペット(6.9)を用いて,Ottaviani & Agostiリステリア寒天培地(附属書B.3)2枚それぞれ
に試料懸濁液(9.1)0.1 mLを移し入れる。Ottaviani & Agostiリステリア寒天培地は,必要であれば事前に
細菌培養器(6.2)内で乾燥させる。以降の10倍段階希釈液についても,必要であれば同じ手順を繰り返
す。
備考 少数のリステリア・モノサイトゲネスの生菌数を測定する必要がある場合,検査する試料懸濁
液量を1.0 mLとすると生菌数測定限界が10分の1に下がる。接種した試料液1 mLは,滅菌済
みのスプレッダー(コンラージ棒)(6.6)を用いて,大形シャーレ(140 mm)の寒天培地1枚,
又は小形シャーレ(90 mm)の寒天培地3枚の全面に塗抹する。いずれの場合も,大形シャー
レ2枚又は小形シャーレ6枚を用いて複製をとる。
9.2.2
シャーレの側面にスプレッダー(コンラージ棒)を接触させずに,接種した試料液を寒天平板の全
面に可能な限り素早く慎重に広げる。平板ごとに新しい滅菌済みスプレッダー(コンラージ棒)を用いる。
平板のふたを閉じ,室温で約15分間静置して,接種した試料液を寒天培地に吸収させる。
備考 希釈度の高いものから始めれば,一つの供試試料に対して同じスプレッダー(コンラージ棒)
を使用できる。
9.2.3
9.2.2に従って作製した平板を倒置し,37 ℃に設定した細菌培養器[6.3 c)]内で培養する。
9.3
典型的コロニーの生菌数測定
9.3.1
24時間の培養及び18〜24時間の追加培養(24時間培養しても増殖がわずかであったり,コロニー
が認められない場合)後,リステリア属と推定されるコロニーの有無について平板を調べる。
9.3.2
周囲に不透明のハロー(halo)を伴った青緑色のコロニー(定形的コロニー)は,リステリア属と
みなす。24±3時間の培養後において,増殖がわずかであった場合,コロニーが全く認められなかった場
合,又は定形的コロニーが存在しなかった場合は,更にその寒天培地を24±3時間再培養する。
備考1. リステリア・モノサイトゲネスの菌株によっては,ストレス,特に酸ストレスがあるとハロー
が非常に弱くなる。ハローを示さないこともある。
2. リステリア・モノサイトゲネスの菌株によっては,遅いPIPLC(ホスハティジル・イノシトー
ル・ホスホリパーゼC)活性によって特定できる。このような菌株は,全培養時間が,例え
ば,4日間を超えるとき検知される。菌株によっては,病原性を示すものがある。
9.3.3
典型的又は非典型的コロニー数が,150未満の平板について,リステリア属と推定されるコロニー
(9.3.2)の全数を数える。
9.4
リステリア属の確認
9.4.1
確認試験用のコロニーの選択
9.4.1.1
培養終了後(9.3.1),全希釈段階(可能であれば,連続する二つの希釈段階)で,リステリア属
と推定されるコロニー数が150未満の平板を選択する。選択した各平板から,リステリア属と推定される
コロニーを5個選ぶ。1平板上の推定コロニーの数が5個未満である場合は,その推定コロニーすべてを
5
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
確認試験用とする。
9.4.1.2
選択したコロニーを,あらかじめ乾燥させておいたトリプトソイ酵母エキス寒天培地(TSYEA,
附属書B.4)上に,よく分離したコロニーが形成されるような方法で画線塗抹する。37 ℃に設定した細菌
培養器[6.3 c)]内に平板を置いて,18〜24時間又は十分に増殖するまで培養する。直径1〜2 mm,凸状
を呈し,全縁をもつ無色不透明のコロニーを定形コロニーとする。コロニーがよく分離していない場合は,
リステリア属の定形コロニーを新たなTSYEA平板に釣菌する。TSYEAで純培養したコロニーについて,
次の試験を実施する。
備考 透過光線試験を実施してもよい(附属書C及び附属書B.4.2の備考参照)。その場合,青みを帯
び,表面が,か(顆)粒状のコロニーが観察される。
9.4.2
カタラーゼ反応 9.4.1.2で分離したコロニーをとり,スライドグラス上に滴下した過酸化水素水
(附属書B.10)1滴に懸濁する。気泡がすぐに発生した場合は,陽性である(JIS K 3701参照)。
9.4.3
グラム染色 9.4.1.2で分離したコロニーにグラム染色を施す(JIS K 3701参照)。リステリア属は,
グラム陽性の細く短いかん(桿)菌(直径約0.4〜0.5 μm,長さ約1〜2 μm)として観察される。
9.4.4
運動性試験(必要な場合) 9.4.1.2で分離したコロニーをとり,TSYEB(附属書B.5)の入った試
験管内で懸濁する。
25 ℃に設定した細菌培養器[6.3 b)]内で8〜24時間,培地に混濁が認められるまで培養する。
白金耳(6.5)を用いて,上記の培養液を清浄な顕微鏡用スライドグラス上に1滴とり,カバーグラスを
かけ,顕微鏡(6.14)で調べる。リステリア属は,回転運動を示す,細く短いかん(桿)菌として観察さ
れる。
25 ℃を超えて培養すると,この運動を示さないことがあるため,常に既知の培養菌と比較する。球菌,
大きなかん(桿)菌又は泳ぐように早く動くかん(桿)菌は,リステリア属ではない。
この他の運動性試験として,接種用白金線(6.5)を用いてTSYEA上の定形コロニー(9.4.1.2)を運動
性試験用寒天培地(附属書B.8)にせん(穿)刺し,25 ℃に設定した細菌培養器[6.3 b)]によって48時
間培養する方法がある。
せん(穿)刺部周辺の菌の発育を調べる。リステリア属は運動性をもち,寒天培地の表面直下に定形な
傘状の発育パターンを示す。発育が十分でない場合は更に最長5日間培養し,この間に培養菌を調べる。
リステリア・モノサイトゲネスの検出に通常従事している微生物学専門家が解析を行う場合,この試験は,
実施しなくてもよい。
9.5
リステリア・モノサイトゲネスの確認
9.5.1
溶血試験
9.5.1.1
形態学的及び生理学的特性,並びにカタラーゼ反応によって,リステリア属であることが示唆さ
れる場合は,ヒツジ血液寒天平板(附属書B.6)で溶血反応を確認する。
使用前に寒天培地の表面を完全に乾燥させ,その寒天培地を四角に区切る。各培養株について,9.4.1.2
で分離したコロニー1個を白金線(6.5)を用いて釣菌し,四角く区切った1区域にせん(穿)刺培養する。
また,陽性リステリア・モノサイトゲネス及び陰性対照培養菌株リステリア・イノキュアのせん(穿)刺
培養も行う。
37 ℃で24±2時間培養後,試験菌株及び対照菌株を調べる。
各平板を透かして観察し,試験菌株と対照菌株とを比較する。
リステリア・モノサイトゲネスは,細く透明で明るいβ 溶血帯を呈するが,リステリア・イノキュアで
はせん(穿)刺部周囲に透明な溶血帯が認められない。L. seeligeriは弱いβ 溶血を示す。リステリア・イ
6
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
バノビは通常,幅広で境界の明りょうなβ 溶血帯を呈する。β 溶血帯は,接種部周辺の寒天培地上に発育
したコロニーを取り除くと,より容易に観察される。
9.5.1.2
溶血反応は,CAMP試験(9.5.3)又は次に述べるような赤血球懸濁液を用いて調べてもよい。150
μLのTSYEB(附属書B.5)中にコロニーを懸濁し,37 ℃で2時間培養する。ヒツジ赤血球懸濁液(附属
書B.12)150 μLを加え,37 ℃で15〜60分間培養後,3±2 ℃で約2時間冷却し,β 溶血の有無を調べる。
溶血反応が明確でない場合は,培養液を3±2 ℃で最長24時間放置する。
9.5.2
炭水化物利用試験(糖発酵試験) 白金耳(6.5)を用いて,炭水化物利用試験(糖発酵試験)用
の各ブロス(附属書B.7)それぞれにTSYEBの培養液(9.4.4)を接種し,37 ℃で最長5日間培養する。
紫から黄へと,色調の段階的な変化が認められた場合は陽性(酸産生)であり,その反応はだいたい24〜
48時間以内に生じる。
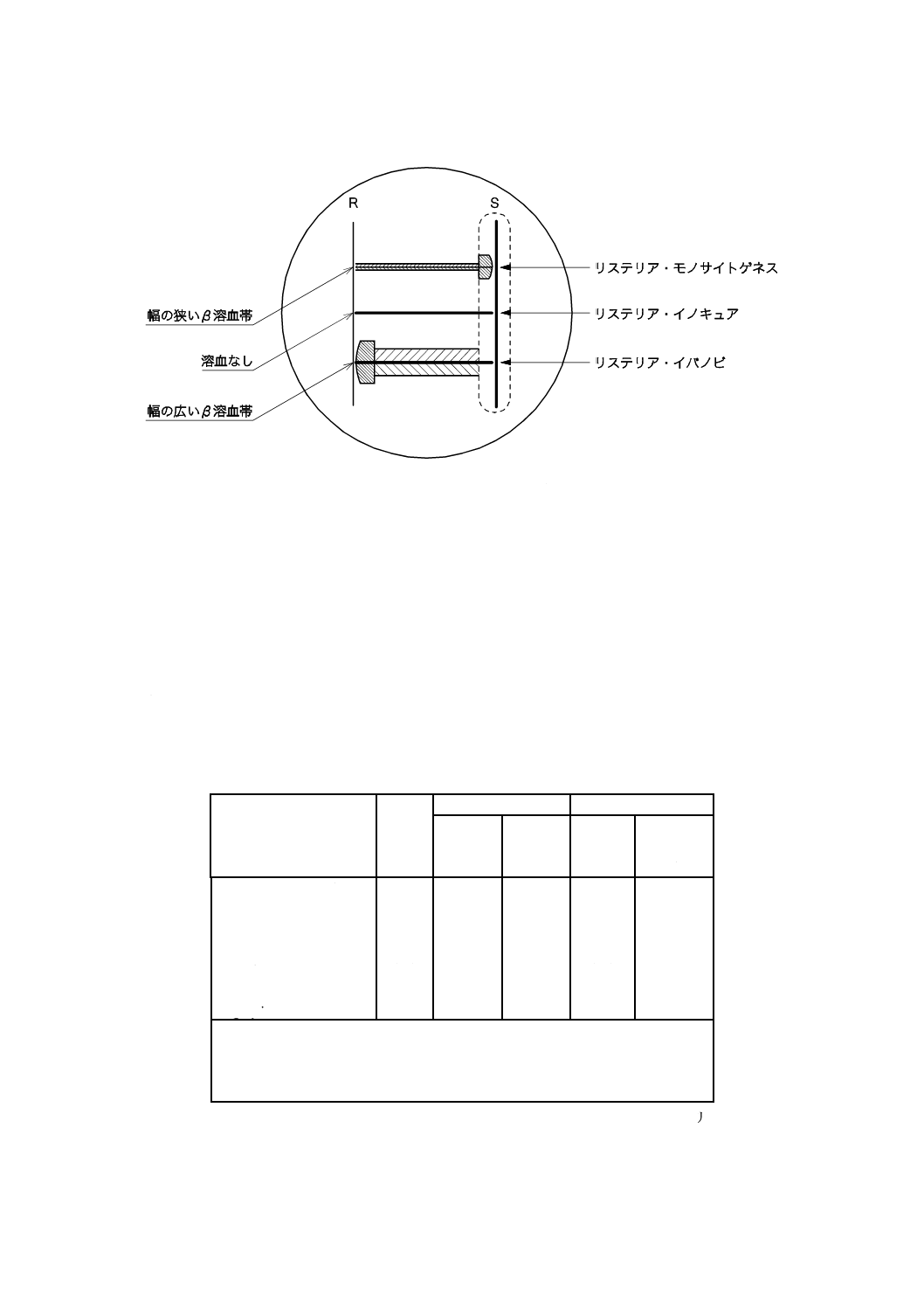
9.5.3 CAMP試験 黄色ブドウ球菌(S. aureus)及びロドコッカス・エクイ(R. equi)(附属書B.9.4)の
培養菌株をそれぞれ,ヒツジ血液寒天平板(附属書B.6又は附属書B.9.3)上に単線で画線塗抹する。その
とき,双方の培養菌株が平行に,かつ,反対側で向かい合う形とする(図1参照)。薄く平らに接種する必
要があるが,接種用白金耳又は白金線(6.5)を寒天平板に対して直角に保持して使用すると,そのように
接種できる。
9.4.1.2で分離された試験菌株を,上記の培養菌株に対して直角となるように,同様の方法で画線塗抹す
る。試験菌株,黄色ブドウ球菌及びロドコッカス・エクイは,接触せず,最も近接する部分で1〜2 mm離
す。数個の試験菌株を同一の平板上に画線塗抹してもよい。
対照菌株であるリステリア・モノサイトゲネス,リステリア・イノキュア及びリステリア・イバノビを
同時に画線塗抹する。ヒツジ血液寒天培地(附属書B.6)を使用する場合は,平板を37 ℃で18〜24時間
培養する。2層平板培地(附属書B.9.3)を使用する場合は,37 ℃で12〜18時間培養する。
試験菌株と各培養菌株[黄色ブドウ球菌及びロドコッカス・エクイ]とが交差する点でβ 溶血帯の増大
が認められれば,陽性とする。
リステリア・イバノビとロドコッカス・エクイとの陽性反応では,幅広(5〜10 mm)で“矢じり形”の
溶血が認められる。試験菌株とロドコッカス・エクイの拡散域との交差点において,溶血の弱い小さな区
域が1 mmほど拡大するだけであれば,陰性とみなす。
リステリア・モノサイトゲネスと黄色ブドウ球菌との陽性反応では,溶血が増強された小さな区域が,
黄色ブドウ球菌の増殖によって弱溶血を生じた区域内に試験菌株からわずか3〜4 mmほど拡大するのが
認められる。黄色ブドウ球菌とリステリア・モノサイトゲネスとが近接する領域では,大きなβ 溶血帯は
生じない。
7
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
図 1 CAMP試験平板における接種及び試験結果の判定
備考 薄いヒツジ血液寒天平板(附属書B.6又は附属書B.9.3)に,図1に示すように接種する。縦の
線は黄色ブドウ球菌(S)及びロドコッカス・エクイ(R)の画線を,横の線は試験菌株の画線
を表す。斜線部は,溶血が増強された部位を示す。点線部分は,黄色ブドウ球菌の影響が及ぶ
領域を示す。
9.6
形態学的・生理学的特性及び生化学反応による同定 リステリア属はいずれも,グラム陽性の小さ
なかん(桿)菌であり,運動性を示す(9.4.4参照)。透過光線によって観察した場合,青みを帯び,か(顆)
粒状の表面を呈したコロニーが認められる。
リステリア属は,一般にカタラーゼ陽性である。リステリア・モノサイトゲネスは,表1に示す特性に
よって他の菌種と識別される。
表1 リステリア属菌種同定のための反応
菌種
溶血性
酸産生
CAMP試験
ラムノ
ース
キシロ
ース
黄色ブ
ドウ球
菌
ロドコッ
カス・エク
イ
リステリア・モノサイト
ゲネス
+
+
−
+
−
リステリア・イノキュア
−
V
−
−
−
リステリア・イバノビ
+
−
+
−
+
L. seeligeri
(+)
−
+
(+)
−
L. welshimeri
−
V
+
−
−
L. grayi
−
−
−
−
−
V :可変的反応
(+):弱い反応
+ :>90 %の陽性反応
− :反応なし
備考 この規格の条件下で,β 溶血又はCAMP試験陽性を示さないリステリ
ア・モノサイトゲネスの菌株がまれに存在する。
8
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
9.7
最終確認 リステリア・モノサイトゲネスと考えられる菌株は,血清型別又はファージ型別のため,
より詳細な試験のできる検査機関に依頼できる。発送するときは,その菌株に関して考えられる全情報を
添付する。
10. 試験結果の表現 JIS K 3701参照。
10.1 リステリア・モノサイトゲネスのコロニー数計測 各平板について,存在するリステリア・モノサ
イトゲネスのコロニー数aを次の式を用いて算出する。aは四捨五入して整数とする。
C
A
b
a
×
=
ここに,
b: Aの中で同定基準に合致するコロニーの数(9.6)
A: 確認試験用として平板培養から選択したコロニーの数(5
個又は5個未満)(9.4.1.1)
C: その平板培養において測定された典型的コロニーの総数
(リステリア属と推定されるコロニーの総数)(9.3.3)
10.2 算出方法
10.2.1 リステリア・モノサイトゲネスのコロニーが150個未満の平板(うち1枚には15個以上のコロニ
ーが認められる場合) 次の式を用いて,試料1 mL又は1 g中に存在するリステリア・モノサイトゲネス
数Nを算出する。
d
n
n
V
a
N
)
1.0
(
2
1+
Σ
=
ここに,
a
Σ: 連続する2希釈段階の全平板(少なくとも1枚には,
同定されたコロニーが15個以上認められる。)におい
て,確認後に算出されたリステリア・モノサイトゲネ
スコロニーの合計数
V : 各平板に接種した試料液の体積(mL)
1n: 第一希釈段階の平板数
2n: 第二希釈段階の平板数
d: 第一希釈段階に相当する希釈率
得られた結果は,四捨五入して有効数字2けた(桁)にする(JIS K 3701参照)。1 mL当たり(液体試
料)又は1 g当たり(その他の試料)のリステリア・モノサイトゲネス数を試験結果とし,1.0〜9.9の数値
と適切な10の累乗の積で表す。
備考 実例については,JIS K 3701参照。
10.2.2 少ない生菌数の概算
10.2.2.1 試料懸濁液の平板2枚に認められるリステリア・モノサイトゲネスのコロニーが15個未満であ
る場合は,10.1に示した式を用いて平板ごとに確認されたコロニーの数を算出し,その2枚の平板で計測
されたコロニー数の算術平均yを算出する。1 g又は1 mL当たりのリステリア・モノサイトゲネスの生菌
概算数NEは,次の式によって算出する。
V
d
y
N
×
=
E
ここに, d: 試料懸濁液の希釈率
V: 各平板に接種した試料液の体積
10.2.2.2 試料懸濁液の平板2枚にコロニーが認められない場合は,次の式のように試験結果を表示する。
9
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
1 g又は1 mL当たりのリステリア・モノサイトゲネス数:
V
d×
1
未満
ここに,
d: 試料懸濁液の希釈率
V: 各平板に接種した試料液の体積
11. 精度 JIS K 3701参照。
12. 培地の品質管理 リステリア・モノサイトゲネスを選択的に発育させるための増菌及び同定用培地の
性能を検査するために,リステリア・モノサイトゲネスの基準株リステリア・モノサイトゲネスATCC6028
及び陰性対照の菌株[かん(桿)菌,連鎖球菌など]の培養液を希釈したものを,一次選択増菌培地(9.2)
に接種する。植菌量は,フラスコ1個当たり10〜100個のリステリア・モノサイトゲネス又は陰性対照菌
株とする。このコントロール(品質管理用)のフラスコを試験菌の培養と同様に処理し(9.5),陽性対照
の培養菌が回収されることを実証する。
備考 基準株リステリア・モノサイトゲネスATCC6028の代わりに新鮮分離株を使用する場合には,
16S rDNA遺伝子の塩基配列によって同定した株だけを用いる(参考文献[1]参照)。
13. 試験報告書 試験報告書には,次の事項を明記する。
a) 試験試料を完全に特定するために必要な全情報
b) 使用した試験試料の採取方法
c) 使用した試験方法
d) 採用した培養温度
e) この規格で規定していないあらゆる操作又は任意としたあらゆる操作についての詳細,及び試験結果
に影響を及ぼす可能性のある全事象についての詳細
f)
得られた試験結果
10
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書A(規定)手順の概略図
試料(x g又はx mL)
+
試料懸濁液の調製に使用する希釈液
[緩衝ペプトン水(附属書B.1)又はhalf Fraserの基礎培地(附属書B.2.1)]
(9x g又は9x mL)
20 ℃,1時間の回復培養(9.1)
Ottaviani & Agostiリステリア寒天培地(附属書B.3)上への接種
37 ℃,24〜48時間培養
リステリア属の同定及び生菌数測定(9.3)
リステリア属の確認(9.4)
・TSYEA培地への接種,37 ℃での培養(9.4.1)
・カタラーゼ反応(9.4.2)
・グラム染色(9.4.3)
・運動性試験(9.4.4)(必要な場合)
リステリア・モノサイトゲネスの確認(9.6)
・溶血試験(9.5.1)
・炭水化物利用試験(糖発酵試験)(9.5.2)
・CAMP試験(9.5.3)
11
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B(規定)培地・試薬の組成及び調製
B.1 緩衝ペプトン水
B.1.1 組成 組成は,附属書B表1による。
附属書B表 1 緩衝ペプトン水の組成
肉ペプトン
10.0 g
塩化ナトリウム(NaCl)
5.0 g
りん酸水素二ナトリウム12水和物(Na2HPO4・12H2O)
9.0 g
りん酸二水素カリウム(KH2PO4)
1.5 g
精製水
1 000 mL
B.1.2 調製 各成分を精製水に溶解する。必要であれば加熱して溶解する。さらに,pHを調整し,滅菌後
のpHを25 ℃で7.0±0.2とする。適切な容量のフラスコ(6.8)に,試験に適した分量となるように培地
を分注する(9.1参照)。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器で15分間滅菌する。
B.2 くえん酸鉄(III)アンモニウムを加えたhalf Fraserブロスの基礎培地(JIS K 3706-1参照)
B.2.1 half Fraserブロスの基礎培地
B.2.1.1 組成 組成は,附属書B表2による。
附属書B表 2 half Fraserブロスの基礎培地の組成
肉ペプトン
5.0 g
カゼインの酵素消化物
5.0 g
肉エキス
5.0 g
酵母エキス
5.0 g
塩化ナトリウム(NaCl)
20.0 g
りん酸水素二ナトリウム二水和物(Na2HPO4・2H2O)
12.0 g
りん酸二水素カリウム(KH2PO4)
1.35 g
エスクリン
1.0 g
精製水
1 000 mL
B.2.1.2 調製 各成分又は粉末培地を精製水に溶解する。必要であれば加熱して溶解する。さらに,pHを
調整し,滅菌後のpHを25 ℃で7.2±0.2とする。適切な容量のフラスコ(6.8)に,試験に適した分量と
なるように培地を分注する(9.1参照)。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器(6.1)で15分間,
滅菌する。
B.2.2 くえん酸鉄(III)アンモニウム溶液
B.2.2.1 組成 組成は,附属書B表3による。
附属書B表 3 くえん酸鉄(III)アンモニウム溶液の組成
くえん酸鉄(III)アンモニウム
5.0 g
精製水
100 mL
B.2.2.2 調製 くえん酸鉄(III)アンモニウムを精製水に溶解し,ろ過し,滅菌する。
12
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.2.3 培地の調製 使用直前に,half Fraserブロスの基礎培地(B.2.1)100 mL当たりにくえん酸鉄(III)アン
モニウム溶液(B.2.2)1.0 mLを加える。
B.3 Ottaviani & Agostiリステリア寒天培地(Agar Listeria according to Ottaviani and Agosti,ALOA)
備考 ALOAは,この検査法に適した培地として市販されているものの一例である。同じ組成・配合
の他の培地を使用しても差し支えない。
B.3.1 基礎培地
B.3.1.1 組成 組成は,附属書B表4による。
附属書B表 4 基礎培地の組成
肉ペプトン
18 g
カゼインの酵素消化物
6 g
酵母エキス
10 g
ピルビン酸ナトリウム
2 g
グルコース
2 g
グリセロリン酸マグネシウム
1 g
硫酸マグネシウム(無水物)
0.5 g
塩化ナトリウム
5 g
塩化リチウム
10 g
りん酸水素二ナトリウム(無水物)
2.5 g
5-ブロモ-4-クロロ-3-インドリル-β-D-グルコピラノシド 0.05 g
寒天
12 g〜18 g (1)
精製水
930 mL (2)
注(1) 寒天のゲル強度による。
(2) アンホテリシンB溶液を使用する場合は925 mL(B.3.5.2参照)
B.3.1.2 調製 各成分の乾燥品又は粉末培地を精製水に煮沸溶解する。121 ℃に設定した乾熱滅菌器又は蒸
気滅菌器で15分間滅菌する。必要であればpHを調整し,滅菌後のpHを7.2±0.2とする。
B.3.2 ナリジクス酸溶液 ナリジクス酸ナトリウム塩を水酸化ナトリウム5 mLに溶解し,ろ過し,滅菌す
る(附属書B表5参照)。
附属書B表 5 ナリジクス酸溶液の組成
ナリジクス酸ナトリウム塩
0.02 g
水酸化ナトリウム(0.05 mol/L)
5 mL
B.3.3 セフタジジム溶液 セフタジジムを精製水5 mLに溶解し,0.45 μmメンブランフィルターでろ過し,
滅菌する(附属書B表6参照)。
附属書B表 6 セフタジジム溶液の組成
セフタジジム
0.02 g
精製水
5 mL
B.3.4 ポリミキシンB溶液 ポリミキシンBを精製水5 mLに溶解し,0.45 μmメンブランフィルターで
ろ過し,滅菌する(附属書B表7参照)。
附属書B表 7 ポリミキシンB溶液の組成
硫酸ポリミキシンB
76 700 IU
精製水
5 mL
13
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.3.5 補充抗生物質
B.3.5.1 シクロヘキシミド溶液 シクロヘキシミドをエタノール2.5 mLに溶解した後,精製水2.5 mLを加
える。0.45 μmメンブランフィルターでろ過し,滅菌する(附属書B表8参照)。
附属書B表 8 シクロヘキシミド溶液の組成
シクロヘキシミド
0.05 g
エタノール
2.5 mL
精製水
2.5 mL
B.3.5.2 アンホテリシンB溶液(シクロヘキシミド溶液の代替として) アンホテリシンをHCl/DMF溶液
に溶解し,0.45 μmメンブランフィルターでろ過し,滅菌する(附属書B表9参照)。
附属書B表 9 アンホテリシンB溶液の組成
アンホテリシンB
0.01 g
HCl(1 mol/L)
2.5 mL
ジメチルホルムアミド(DMF)
7.5 mL
警告事項 HCl/DMF溶液は有毒であるため,取り扱いに注意する。
B.3.6 追加添加溶液 L-α-ホスファチジルイノシトール(Sigma P6636)2 gを低温の精製水50 mLに溶解
する。均質な懸濁液が得られるまで30分ほどかくはんする。121 ℃,15分間乾熱滅菌器又は蒸気滅菌器
で滅菌後,48〜50 ℃まで冷却する。
備考 Sigma P6636はSigma社から販売されている製品である。同じ結果となることが証明できれば,
同等の他製品を使用できる。
B.3.7 完全培地
B.3.7.1 組成 組成は,附属書B表10による。
附属書B表 10 完全培地の組成
基礎培地(B.3.1)
930 mL (2)
ナリジクス酸溶液(B.3.2)
5 mL
セフタジジム溶液(B.3.3)
5 mL
ポリミキシンB溶液(B.3.4)
5 mL
シクロヘキシミド溶液(B.3.5.1)
5 mL
又はアンホテリシンB溶液(B.3.5.2)
10 mL
追加添加溶液(B.3.6)
50 mL
注(2) アンホテリシンB溶液を使用する場合は925 mL
B.3.7.2 調製 50 ℃で融解している基礎培地に各溶液を添加する。各溶液を加えるごとに十分に混和する。
完全培地のpHは,25 ℃で7.2±0.2とする。培地は,均一に不透明でなければならない。
B.3.7.3 寒天平板の作製 新たに調製した完全培地を各シャーレに15〜20 mL注ぎ込み,固化させる。
B.4 固形培地:トリプトソイ酵母エキス寒天培地(Tryptone soya yeast extract agar,TSYEA)
B.4.1 組成 組成は,附属書B表11による。
14
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B表 11 トリプトソイ酵母エキス寒天培地の組成
カゼインの酵素消化物
17.0 g
大豆ミール(大豆粕)の酵素消化物
3.0 g
塩化ナトリウム(NaCl)
5.0 g
りん酸水素二カリウム(K2HPO4)
2.5 g
D-グルコース
2.5 g
酵母エキス
6 g
寒天
9〜18 g (1)
精製水
1 000 mL
注(1) 寒天のゲル強度による。
B.4.2 調製 各成分又は粉末培地を精製水に煮沸溶解する。必要であればpHを調整し,滅菌後のpHを
25 ℃で7.3±0.2とする。適切な容量の試験管に,試験に適した分量となるように培地を分注する。121 ℃
に設定した乾熱滅菌器又は蒸気滅菌器で15分間滅菌する。斜面となるように固化させる。寒天平板を作製
するには,試験に適した分量の培地を滅菌シャーレに分注して固化させる。
備考 透過光線試験を実施する場合,寒天培地の層を薄くする(直径90 mmのシャーレ1枚当たり約
12 mL)ことが重要である。
B.5
液体培地:トリプトソイ酵母エキスブロス(Tryptone soya yeast extract broth,TSYEB)
B.5.1 組成 組成は,附属書B表12による。
附属書B表 12 トリプトソイ酵母エキスブロスの組成
カゼインの酵素消化物
17.0 g
ソイペプトン
3.0 g
塩化ナトリウム(NaCl)
5.0 g
りん酸水素二カリウム(K2HPO4)
2.5 g
D-グルコース
2.5 g
酵母エキス
6 g
精製水
1 000 mL
B.5.2 調製 各成分又は粉末培地を精製水に溶解する。必要であれば加熱して溶解する。必要であれば
pHを調整し,滅菌後のpHを25 ℃で7.3±0.2とする。適切な容量のフラスコ又は試験管に,試験に適し
た分量となるように培地を分注する。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器で15分間滅菌する。
B.6 ヒツジ血液寒天培地
B.6.1 基礎培地
B.6.1.1 組成 組成は,附属書B表13による。
附属書B表 13 基礎培地の組成
肉ペプトン
15 g
肝酵素消化物
2.5 g
酵母エキス
5 g
塩化ナトリウム(NaCl)
5 g
寒天
9〜18 g (1)
精製水
1 000 mL
注(1) 寒天のゲル強度による。
15
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.6.1.2 調製 各成分又は粉末培地を精製水に煮沸溶解する。必要であればpHを調整し,滅菌後のpHを
25 ℃で7.2±0.2とする。適切な容量のフラスコに,試験に適した分量となるように培地を分注する。121 ℃
に設定した乾熱滅菌器又は蒸気滅菌器で15分間滅菌する。
B.6.2 完全培地
B.6.2.1 組成 組成は,附属書B表14による。
附属書B表 14 完全培地の組成
基礎培地(B.6.1)
100 mL
脱線維素ヒツジ血液
5〜7 mL
B.6.2.2 調製 あらかじめ47 ℃に冷却しておいた基礎培地に血液を加え,よく混和する。試験に適した分
量の培地を滅菌シャーレに分注し,固化させる。
B.7 炭水化物利用試験(糖発酵試験)用ブロス(ラムノース及びキシロース)
B.7.1 基礎培地
B.7.1.1 組成 組成は,附属書B表15による。
附属書B表 15 基礎培地の組成
肉ペプトン
10 g
肉エキス
1 g
塩化ナトリウム(NaCl)
5 g
ブロモクレゾールパープル
0.02 g
精製水
1 000 mL
B.7.1.2 調製 各成分を精製水に溶解する。必要であれば加熱して溶解する。必要であればpHを調整し,
滅菌後のpHを25 ℃で6.8±0.2とする。適切な容量の試験管に,試験に適した分量となるように培地を分
注する。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器で15分間滅菌する。
B.7.2 糖液
B.7.2.1 組成 組成は,附属書B表16による。
附属書B表 16 糖液の組成
炭水化物(糖質)(3)
5 g
精製水
100 mL
注(3) L-ラムノース又はD-キシロース
B.7.2.2 調製 各炭水化物(糖質)をそれぞれ別個に精製水100 mLに溶解し,ろ過し,滅菌を行う。
B.7.3 完全培地 各炭水化物(糖質)について,B.7.2の溶液x mLを基礎培地(B.7.1)9x mLに無菌的に
加える。
B.8 運動性試験用寒天培地
B.8.1 組成 組成は,附属書B表17による。

16
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書B表 17 運動性試験用寒天培地の組成
カゼインの酵素消化物
20.0 g
肉ペプトン
6.1 g
寒天
3.5 g
精製水
1 000 mL
B.8.2 調製 各成分を精製水に煮沸溶解する。必要であればpHを調整し,滅菌後のpHを25 ℃で7.3±0.2
とする。試験管に培地を約5 mLずつ分注する。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器で15分間滅
菌する。
B.9
CAMP(Christie,Atkins,Munch-Peterson)試験用培地及び試験菌株
備考 ヒツジ血液寒天平板(B.6)を用いてもよいが,ヒツジ血液培地の層が非常に薄い2層寒天平板
を用いるほうがよい(B.9.3参照)。
B.9.1 基礎培地 B.6.1参照。
B.9.2 ヒツジ血液培地 B.6.2参照。
B.9.3 完全培地 基礎培地(B.9.1)を滅菌シャーレに分注する。シャーレの直径が90 mmの場合は約12
mLを分注し,固化させる。ヒツジ血液培地(B.9.2)を1平板当たり3 mL以下の量で非常に薄く均一に重
層し,固化させる。
備考 事前に作製しておいた基礎培地平板に血液培地を加える場合は,血液培地を注入する前に,そ
の平板を37 ℃に設定した細菌培養器内に20分間置いて加温しなくてはならないことがある。
B.9.4 CAMP試験用菌株 β 溶血の黄色ブドウ球菌菌株(NBRC 11462, NCTC 1803,ATCC 25923など),
ロドコッカス・エクイ菌株(NBRC 14956, NCTC 1621,ATCC 6939など)及びリステリア・モノサイト
ゲネス菌株(NCTC 11994など)が,必要である。黄色ブドウ球菌及びリステリア・モノサイトゲネスの
全菌株がCAMP試験に適しているわけではない。黄色ブドウ球菌,ロドコッカス・エクイ,リステリア・
モノサイトゲネス,リステリア・イノキュア及びリステリア・イバノビの保存培養は,TSYEA斜面培地(B.4)
に接種後,37 ℃で24〜28時間又は菌が増殖するまで培養し,3±2 ℃で冷蔵庫に保存して維持する。継代
培養は少なくとも1か月に1度行い,TSYEA平板(B.4)に画線培養して純度を確認する。
B.10 過酸化水素水 濃度3 質量分率%(10倍希釈)の溶液を使用する。
B.11 りん酸緩衝生理食塩水(PBS)(任意)
B.11.1 組成 組成は,附属書B表18による。
附属書B表 18 りん酸緩衝生理食塩水の組成
りん酸水素二ナトリウム二水和物(Na2HPO4・2H2O)
8.98 g
りん酸二水素ナトリウム(NaH2PO4)
2.71 g
塩化ナトリウム(NaCl)
8.5 g
精製水
1 000 mL
B.11.2 調製 各成分を精製水に溶解する。必要であればpHを調整し,滅菌後のpHを25 ℃で7.2±0.2
とする。121 ℃に設定した乾熱滅菌器又は蒸気滅菌器で15分間滅菌する。
17
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
B.12
ヒツジ赤血球懸濁液(任意) ヒツジ赤血球は,使用時まで3±2 ℃に保つ。使用前,上部の血清
層に溶血の形跡(赤変)がないか調べる。溶血が認められなければ,下部の赤血球層2 mLをとりPBS緩
衝液(B.11)98 mLに加える。溶血が生じていた場合は,赤血球層約4 mLをPBS緩衝液10 mLに懸濁し
て静かに混和し,遠心分離する。著しい溶血によって上部血清層に明らかな赤変が認められる場合,その
保存懸濁液は使用しない。認められなければ,上部血清層をデカントで捨て,その赤血球懸濁液2 mLを
PBS緩衝液98 mLに加える。懸濁液は,3±2 ℃で保存する。保存期間は,5日間以内とする。溶血が生じ
た場合は,使用しない。
18
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書C(参考)透過光線試験(斜光法)
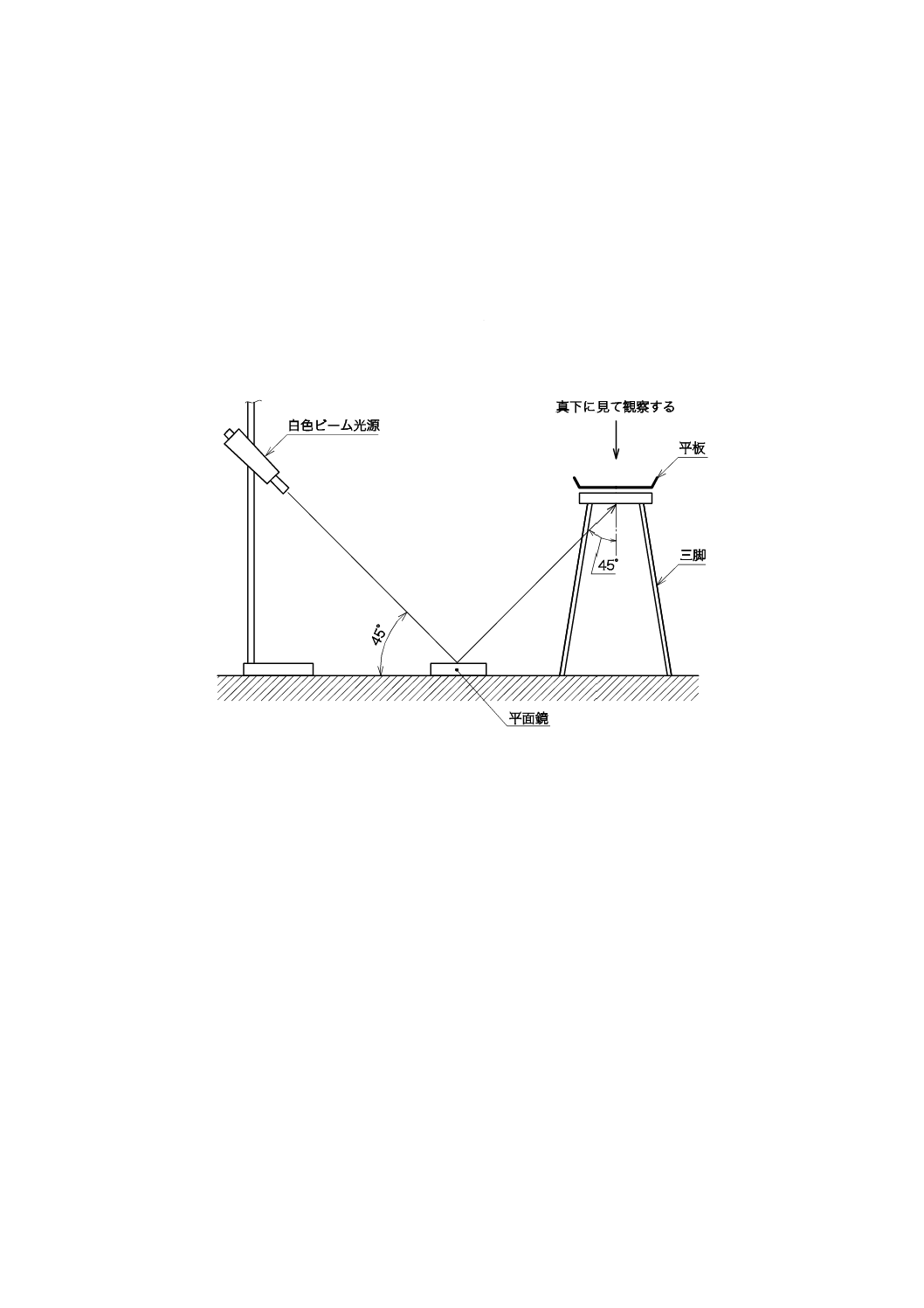
この附属書は,本体及び附属書(規定)に関連する事柄を補足するもので,規定の一部ではない。
白色ビーム光源を用いて平板を調べる。白色光線は,平板をよく照らすのに十分な強度で,平板の底面
に45°の角度で当たるものとする。この斜めの透過光線の下で平板を真上から調べた場合,リステリア・
モノサイトゲネスのコロニーは,青みを帯びた色で表面は か(顆)粒状を呈している。
附属書C図1 疑わしいコロニーについての平板検査
19
K 3706-2:2008
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
参考文献
[1] Jones,D.,Seeliger,H.P.,Designation of a new type strain for Listeria monocytogenes,Request for an Opinion.
Int. J. Syst. Bacteriol. 33:429,1983.
2
0
K
3
7
0
6
-2
:
2
0
0
8
2
0
K
3
7
0
6
-2
:
2
0
0
8
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
附属書1(参考)JISと対応する国際規格との対比表
JIS K 3706-2:2008 培地の試験方法―リステリア・モノサイトゲネス用培地―第2
部:リステリア・モノサイトゲネスの生菌数測定
ISO 11290-2:1996 食品及び動物用飼料の微生物試験―リステリア・モノサイ
トゲネスの検出及び菌数測定方法―第2部:菌数測定方法及びAMENDMENT 1
(2004)
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体,附属書
表示方法:点線の下線
(Ⅴ) JISと国際規格との技術的差
異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
1.適用範囲
培地を用いてリステ
リア・モノサイトゲネ
スの生菌数を測定す
る方法について規定。
ISO
11290-2
1
JISと同じ。
MOD/変更
培地試験方法に限定した。
工業標準化の対象範囲(培地)
を明確にした。
2.引用規格
JIS K 3701
JIS K 3702
JIS K 3706-1
2
ISO 7218
ISO 6887-1
ISO 11290-1
IDT
JIS K 8008
−
MOD/追加
−
追加した用語を規定するため。
3.定義
用語の定義を規定
3
JISとほぼ同じ。
MOD/追加
用語(水)を追加
JISとして必要な用語を規定。
4.一般原則
リステリア・モノサイ
トゲネスの生菌数を
測定するための段階
操作を規定。
4
JISと同じ。
IDT
5.培地及び試
薬
培地及び試薬につい
て規定。
5
JISと同じ。
IDT
6.装置及びガ
ラス器具
通常の微生物検査に
用いる装置及びガラ
ス器具(乾熱滅菌器及
び乾燥キャビネット
など)について規定。
6
JISとほぼ同じ。
MOD/選択
6.3の温度(35±1 ℃)を削除し,
選択。
国内の使用実態を反映した。実
質上の差異なし。
2
1
K
3
7
0
6
-2
:
2
0
0
8
2
1
K
3
7
0
6
-2
:
2
0
0
8
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
(Ⅰ) JISの規定
(Ⅱ) 国際
規格番号
(Ⅲ) 国際規格の規定
(Ⅳ) JISと国際規格との技術的差異の項目ごとの
評価及びその内容
表示箇所:本体,附属書
表示方法:点線の下線
(Ⅴ) JISと国際規格との技術的差
異の理由及び今後の対策
項目
番号
内容
項目
番号
内容
項目ごとの
評価
技術的差異の内容
7.サンプリン
グ方法
試料のサンプリング
方法について規定。
7
JISと同じ。
IDT
8.試料の調製
試料の調製について
規定。
8
JISと同じ。
IDT
9.手順
手順(接種,培養,及
びリステリア・モノサ
イトゲネスの確認な
ど)について規定。
9
JISとほぼ同じ。
MOD/追加
9.5.1.1の備考でリステリア・モ
ノサイトゲネスの説明を追記。
実質的な技術的差異なし。
10.試験結果
の表現
試験結果の表現(リス
テリア・モノサイトゲ
ネスのコロニー数計
測など)について規
定。
10
JISと同じ。
IDT
11.精度
精度について規定
11
JISと同じ。
IDT
12.培地の品
質管理
リステリア・モノサイ
トゲネス用培地の品
質管理について規定。
12
JISと同じ。
MOD/追加
基準株の名称及び備考(基準株
の代替新鮮分離株)を追記。
利用者の利便性のため。
実質的な技術的差異なし。
13.試験報告
書
試験報告書(培養温度
など)について規定。
13
JISと同じ。
IDT
附属書A
(規定)
手順の概略図
附属書A
JISと同じ。
IDT
附属書B
(規定)
培地・試薬の組成及び
調製
附属書B
JISと同じ。
IDT
附属書C
(参考)
透過光線試験(斜光
法)
附属書C
JISと同じ。
IDT

2
2
K
3
7
0
6
-2
:
2
0
0
8
2
2
K
3
7
0
6
-2
:
2
0
0
8
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
JISと国際規格との対応の程度の全体評価:MOD
備考1. 項目ごとの評価欄の記号の意味は,次のとおりである。
― IDT……………… 技術的差異がない。
― MOD/追加……… 国際規格にない規定項目又は規定内容を追加している。
― MOD/変更……… 国際規格の規定内容を変更している。
― MOD/選択……… 国際規格の規定内容と別の選択肢がある。
2.
JISと国際規格との対応の程度の全体評価欄の記号の意味は,次のとおりである。
― MOD…………… 国際規格を修正している。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。
2019年7月1日の法改正により名称が変わりました。まえがきを除き,本規格中の「日本工業規格」を「日本産業規格」に読み替えてください。